Виды бактериологических исследований. Методические рекомендации. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии
УТВЕРЖДЕНЫ Министерством
здравоохранения РСФСР от 19 декабря 1991 г.
Методические рекомендации
составил А.Н.Калюк.
Бактериологические исследования на условно-патогенные микроорганизмы
Комплексное лабораторное
изучение микрофлоры включает бактериоскопическое и
бактериологическое исследования материала, проводимые в динамике
при поступлении на стационарное лечение, в процессе лечения, а
также по показаниям у больных, лечащихся амбулаторно. Посевы
диагностического материала целесообразно производить на плотные
питательные среды, что исключает подавление роста одного
микроорганизма другим и позволяет дать количественную оценку числа
выросших колоний. Интенсивность роста микроорганизмов может
выражаться в крестах и соответствовать содержанию определенного
количества микробных клеток в 1 мл диагностического материала:
++++ обильный рост
сливающихся колоний (10 м/кл)
+++ массивный рост
изолированных колоний (10 м/кл)
++ умеренный рост
множества сосчитываемых колоний (не менее 50) (10-10 м/кл)
+
скудный рост единичных колоний (30-50) (10 м/кл).
При дозированном посеве
определяют абсолютное содержание микроорганизмов в 1 мл или 1 г
исследуемого материала. Этиологически значимым содержанием бактерий
в 1 мл (1 г) материала признается 10 и выше. Количественное преобладание
определенного вида микроорганизма является одним из показателей его
участия в гнойно-воспалительном процессе. Окончательная
интерпретация результатов бактериологического исследования
производится после изучения анамнестических данных, клинической
симптоматики, результатов антибактериальной терапии. При
направлении материала на посев необходимо соблюдать определенные
правила. Материал должен быть исследован до начала
антибактериальной терапии или через такой период после введения
антибактериальных препаратов, который необходим для их элиминации
из организма больного (2-3 дня при анализах мокроты, 4-7 дней -
мочи). Применение антибиотиков в 3-4 раза снижает частоту выделения
микроорганизмов. Посевы диагностического материала проводятся в
динамике (3-5 раз), что уточняет этиологию заболевания, дает
возможность проследить длительность персистенции возбудителя,
контролировать эффективность проводимой терапии. Интервал между
сбором и посевом материала не должен превышать 1-2 ч.
Исследование микрофлоры
верхних дыхательных путей (глотка, нос, ротовая полость).
Материалом для исследования служат: слизь, гнойное отделяемое,
корочки, пленка, кусочки инфильтратов при биопсии. Материал для
микробиологического исследования из ротовой полости забирают
натощак стерильным ватным тампоном со слизистой оболочки у выхода
протоков слюнных желез, поверхности языка, из язвочек (соскоб
ложечкой), с наиболее пораженных мест. При наличии пленки последнюю
снимают пинцетом. Материал из носовой полости забирают сухим
стерильным ватным тампоном. Материал засевают на чашки Петри с
кровяным, желточно-солевым агарами, среду Сабуро. При посеве
тампоном материал втирают в среду со всей поверхности тампона на
небольшом участке 1-2 см, а затем штрихами по всей поверхности.
Одновременно с посевом приготавливают мазки и окрашивают по
Граму.
Исследование микрофлоры
нижних дыхательных путей. Основным материалом для исследования
является мокрота, которая собирается в день исследования, утром,
после чистки зубов и полоскания полости рта свежекипяченой водой.
При обильном выделении мокроты первые порции следует откашлять в
плевку, а последующие собираются в стерильную посуду и доставляются
в лабораторию. Для изучения микрофлоры мокроты применяют как посев
неразведенной мокроты (качественный метод), так и метод разведения,
который получил название количественного. При качественном методе
для посева используются гнойные комочки мокроты, отмытые в
физиологическом растворе от микрофлоры ротовой полости. При
количественных методах гомогенизируется 1 мл мокроты. Затем
производятся разведения, позволяющие уменьшить в ней количество
микроорганизмов ротовой полости. При обоих методах одновременно с
посевом приготавливается мазок, который окрашивается по Граму.
Исследованию подлежат гнойная и слизисто-гнойная мокрота, в которой
присутствуют лейкоциты и клетки альвеолярного эпителия, клетки,
вкрапленные в муцин, присутствие которых характерно для экскрета
нижних отделов дыхательных путей. Обращают внимание на
преобладающую в мазке нативной мокроты микрофлору, особенно
капсульные диплококки (пневмококки), мелкие грамотрицательные
палочки (палочка Пфейффера) и др.
Качественный метод. В
лаборатории мокроту выливают в чашку Петри, выбирают 2-3 гнойных
комочка, которые однократно отмывают в физиологическом растворе,
после чего засевают на кровяной и желточно-солевой агары, среды
Эндо и Сабуро. Посев производят стерильным стеклянным шпателем,
равномерно растирая материал на поверхности питательной среды. На
чашку с кровяным агаром сразу же после посева накладывают диски с
антибиотиками (стрептомицином, пенициллином, тетрациклином,
эритромицином и левомицетином), что позволяет получить
экспресс-информацию о лекарственной чувствительности преобладающей
в посеве микрофлоры. На второй день учитывают количество выросших
колоний (этиологически значимым считается рост более 50 колоний),
однородность популяции и лекарственную чувствительность при росте
их в монокультуре.
Количественный метод. Из
доставленной в лабораторию мокроты берут 1 мл, добавляют 9 мл
мясопептонного бульона и гомогенизируют в банке с бусами в течение
20 мин. Из полученной эмульсии готовят десятикратные
последовательные разведения. Посев осуществляют в обратном порядке
с меньшего разведения. Засевается по 0,1 мл из разведенной мокроты
10 и 10 на чашку с кровяным агаром. Посев на
желточно-солевой агар, среды Эндо и Сабуро делают из исходного
разведения 1:10. Посевы инкубируют в течение суток при 37°С. На
вторые сутки чашки просматривают и учитывают численность каждого из
видов микроорганизмов в миллионах. Диагностически значимым
признается содержание бактерий 10 м/кл и выше в 1 мл мокроты.
Посев промывных вод
бронхов, лаважной жидкости. Из исследуемого материала отбирают
комочки слизи, которые без предварительного отмывания в
физиологическом растворе засевают на плотные питательные среды (см.
посев мокроты) и в пробирку с сахарным бульоном. При отсутствии
комочков слизи производят посев материала, набранного в
пастеровскую пипетку. Инкубация в течение суток при 37°С.
Исследование микрофлоры
глаз. Пробы на исследование отбирает врач стерильным ватным
тампоном или стеклянной палочкой. Материал забирается с пораженных
мест и засевается в 0,5% сахарный бульон. В случае отсутствия роста
через 48 часов выдается отрицательный ответ.
Исследование мазков из
уха. Материал забирают стерильным ватным тампоном из слухового
канала и производят посев на кровяной и желточно-солевой агары,
среду Сабуро, втирая материал на участке среды, после чего
растирают по всей чашке.
Исследование мочи.
Исследованию подлежит средняя порция утренней мочи, полученная при
нормальном мочеиспускании или взятая катетером. Показателем
бактериурии, имеющим клиническое значение, считается наличие 100000
и более микробов в 1 мл мочи.
Первый день исследования.
Производят посев одной стандартной (3 мм) бактериологической петли
мочи (тщательно перемешанной) по секторам А, I, II и III в чашку
Петри с 5% кровяным или простым агаром. При этом в участке среды
сектора А делают посев, равномерно втирая материал по всей
поверхности, затем не беря нового материала, этой же петлей делают
посев штрихами на питательную среду в секторе I (3-4 штриха), из
сектора I во II, из II сектора - в III.
Таблица 1
Число колоний бактерий в различных секторах чашки Петри в зависимости от степени бактериурии (по В.С.Рабиновскому и В.В.Родоман)
|
Количество бактерий в 1 мл мочи |
Число колоний в различных секторах чашки Петри |
|||
|
Менее 1
тыс. |
роста нет |
роста нет |
||
|
очень большое |
||||
|
от единич. до 25 |
||||
Второй день исследования.
Определяют степень бактериурии по табл.1 в зависимости от того, в
каком секторе обнаружен рост колоний микроорганизма. При наличии
менее 100 тыс. микробов в 1 мл мочи рост колоний наблюдается только
в секторе А чашки Петри. Появление роста колоний в I секторе
указывает на более высокую степень бактериурии. Подсчет колоний в
секторе с наименьшим ростом не представляет труда. Метод секторных
посевов в большинстве случаев позволяет уже на второй день
исследования выделить возбудителя заболевания в чистой
культуре.
Исследование микрофлоры
ран, пунктатов, экссудатов, резецированных тканей. Экссудаты и
пунктаты засевают пастеровской пипеткой в пробирки с кровяным и
простым мясопептонным агаром, сахарным бульоном. Тампон с
диагностическим материалом засевают на чашки Петри с 5% кровяным и
10% желточно-солевым агарами. Материал втирается по краю среды, а
затем рассеивается по чашке при помощи этого же тампона или
бактериологической петли.
Исследование микрофлоры
женских половых органов. Выделения собирают с помощью стерильного
ватного тампона и засевают на чашки Петри с 5% кровяным агаром,
желточно-солевым агаром и в пробирку с сахарным бульоном, а также
на среду Эндо.
Исследование желчи. Желчь
собирают при зондировании или во время операции в стерильные
пробирки и доставляют в лабораторию не позднее 2 ч. от момента
забора. 0,1 мл желчи высевают на чашку с кровяным агаром и на среду
Эндо. Посевы и оставшийся исходный материал помещают в термостат
при 37°С. Через 24 часа учитывают результаты первичных посевов с
подсчетом количества колоний каждого вида на плотных питательных
средах.
Исследование крови. Кровь
сеют у постели больного после тщательной обработки кожи (спирт,
эфир). Из локтевой вены берут 10 мл крови, которую выливают в две
колбы: первую со 150-200 мл сахарного бульона и вторую с
тиогликолевой средой (по 5 мл). Посевы выдерживают в термостате в
течение 10 дней. На 2, 3, 5 и 10-й дни производят контрольные
высевы на чашки Петри с 5% кровяным агаром. Посев 5 мл крови можно
произвести во флакон с питательной средой в двух фазах: плотной и
жидкой (скос 5% кровяного агара с 1% глюкозы и 50 мл 0,5% сахарного
бульона). Такая методика исключает необходимость многократных
пересевов, устраняет возможность загрязнения посева микрофлорой
окружающей среды, позволяет учесть количество выросших колоний
(т.е. оценить напряженность бактериемии). Посев помещают в
термостат при 37°С на 10 суток. Ежедневно содержимое флаконов
взбалтывают и наклоном флакона смачивают поверхность скоса плотной
питательной среды. При появлении роста колоний на скосе кровяного
агара с них приготавливают мазки и далее идентифицируют по
общепринятым в бактериологии правилам. При отсутствии роста
микроорганизмов на 10-е сутки дается окончательный ответ - посев
крови стерилен.
Исследование на
дисбактериоз кишечника. На предварительно подготовленные и
взвешенные (подпергамент или вощанку) стерильные бумажки размером
3x2 берут произвольное количество фекалий и взвешивают на
торзионных весах. Бумажку вместе с материалом помещают в стерильную
пробирку. Вес навески фекалий, за вычетом веса бумажки, умножают на
9. Полученная после умножения сумма равна количеству
физиологического раствора, которое необходимо добавить в пробирку.
Разведение 1:10 (I).
Например: вес бумажки 20
мг
вес фекалий с бумажкой
420 мг
420-20=400 мг; 400
мг9=3600 (3,5 мл).
После эмульгирования
стеклянной палочкой или стерильной пипеткой взвеси дают отстояться
при комнатной температуре 10-15 мин и 0,1 мл переносят в следующую
пробирку с 9,9 мл физиологического раствора (разведение 10). Затем производят разведение фекалий до
титра 10. Из основного разведения (10) производят посев на плотные питательные
среды для выделения патогенных микробов семейства кишечных (среду
Плоскирева, Левина). Одновременно делают массивный (0,5-1,0) посев
на жидкие среды обогащения (Мюллера, селенитовую, магниевую). Из
пробирки, в которой фекалии разведены до 10, вносят по 0,1 мл на поверхность среды
Сабуро и ЖСА. Из разведения 10 производят посевы на чашки с 0,5% кровяным
агаром и среду Эндо по 0,1 мл. Для получения роста изолированных
колоний применяют стеклянные бусы или шпатели. Стеклянные круглые
бусы 12-14 штук (заранее простерилизованные) опускают в чашку с
посевным материалом. При легком покачивании чашки с бусами в
течение 1 мин материал равномерно распределяется по питательной
среде. Посев бусами начинают со среды, на которой посеяно
наибольшее разведение (10), перенося бусы на меньшее разведение. Для
выделения анаэробных бифидобактерий производят высев из разведений
10, 10 и 10 в 2 пробирки (по 0,1 и 1 мл)
регенерированной в течение 1 ч среды Блаурокка. После посева
пробирки энергично вращают между ладонями для равномерного
распределения взвеси. Среды для выращивания аэробов помещают в
термостат при 37°С (Сабуро - при 20°) на 18-24 часа. Рост анаэробов
на среде Блаурокка учитывают через 48-72 ч. На следующий день после
посева определяют количество кишечной палочки и других микробов в 1
г фекалий по числу колоний, выросших на соответствующей питательной
среде с пересчетом на количество посеянного материала и степени его
разведения. Так, если на среде Эндо выросло 30 лактозонегативных
колоний при посеве 0,1 мл фекалий из разведения 10 (1:100000), при расчете следует 30 умножить
на 10 и на 100000, т.е. в 1 г будет 30000000 лактозонегативных
энтеробактерий. Учитывают число лактозонегативных и гемолитических
колоний кишечной палочки, наличие стафилококка, протея и других
микроорганизмов. Определяются ферментативные свойства и
лекарственная чувствительность микроорганизмов. Из пробирок со
средой Блаурокка приготавливаются мазки. Под микроскопом
бифидобактерий имеют вид характерных грамположительных палочек,
утолщенных или разветвленных на концах, расположенных в виде
римской цифры V, часто в виде скоплений. В ответе бактериолога
указываются процент или абсолютное количество каждой группы
микроорганизмов.
Идентификация
микроорганизмов. Методы идентификации микроорганизмов основаны на
изучении морфологических, культуральных и биохимических, антигенных
и др. свойств культур.
Морфологические свойства
изучаются путем бактериоскопии диагностического материала и мазков
из колоний, выросших на плотных и жидких питательных средах
культур. Мазки на предметных стеклах фиксируют на пламени горелки
или в жидких фиксаторах (96°, спирт, смесь Никифорова) окрашивают
по Граму. При просмотре мазков из мокроты оценивают всю имеющуюся
микрофлору: наличие скоплений грамположительных кокков
(стафилококки, микрококки), цепочек грамположительных кокков
(стрептококки), мелких ланцетовидных диплококков, окруженных зоной
неокрасившейся капсулы (пневмококк), грамотрицательных кокков
(нейссерии); грамотрицательных палочек (кишечная, синегнойная,
протей); грамотрицательных палочек с закругленными концами,
окруженных капсулой в виде светлого ореола (клебсиелла), мелких
грамотрицательных палочек в виде скопления (гемофильные бактерии) и
др. Бактериоскопическое исследование является ориентировочным.
Дальнейшее исследование включает посев материала на питательные
среды, выделение чистых культур, их идентификацию и определение
лекарственной чувствительности. Культуральные свойства изучают при
просмотре выросших культур на плотных и жидких питательных средах.
На плотных средах учитывают размер колоний, цвет, прозрачность,
форму, наличие пигмента, гемолиз вокруг колонии и его характер и
т.д. На жидких средах отмечают их прозрачность, наличие осадка
(придонный рост) или пленки на поверхности среды. Исследование
биохимических свойств основывается на определении ферментативной
сахаролитической активности, способности утилизировать питательные
вещества в аэробных и анаэробных условиях культивирования.
Антигенные свойства культур изучаются при взаимодействии бактерий и
их антигенов с соответствующими антисыворотками (реакции
агглютинации, иммунофлюоресценции и др.). После изучения
морфологических и культуральных свойств осуществляют постановку
дифференциальных тестов с чистыми культурами микроорганизмов.
Грамположительные кокки.
Грамположительные кокки относятся к семейству Micrococcaceae,
включающему род Micrococcus и Staphylococcus и семейства
Streptococcaceae.
Семейство Micrococcaceae.
Для медицинской микробиологии необходимо дифференцировать
стафилококки от микрококков. Изучают морфологические свойства,
гемолиз, способность расти на среде с солью, пигментообразование,
ферментацию глюкозы до кислоты в анаэробных условиях, ферментацию
глицерина. Микрококки имеют в 2-3 раза больший размер клеток
(0,5-3,5 мкм), не ферментируют глюкозу в анаэробных условиях и
глицерин, имеют пигмент от желтого до розового. Дифференциация
различных видов стафилококка осуществляется по комплексу тестов:
плазмокоагулирующей способности, лецитиназной активности,
ферментации маннита в анаэробных условиях, пигментообразованию,
чувствительности к новобиоцину (тест - положительный у St. aureus и
St. epidermidis и отрицательный у St. saprophyticus). Для выделения
стафилококка исследуемый материал засевают на
дифференциально-диагностическую среду: желточно-солевой агар. При
окраске по Граму стафилококк окрашивается грамположительно и
располагается одиночно, попарно или образует скопления в виде
неправильных кучек. Стафилококк устойчив к повышенным концентрациям
в среде хлористого натрия (7-10%), что используется для его
выделения из патологического материала. При росте на мясопептонном
бульоне вызывает его равномерное помутнение и дает хлопьевидный
осадок. На плотных питательных средах стафилококк растет в виде
круглых блестящих колоний с ровными краями (0,5-1,5 мм в диаметре).
На второй день исследования оценивают количественный рост выросших
колоний, учитывают лецитиназную активность, выделяют чистую
культуру микроба (пересев на пробирки с молочным или простым
скошенным агаром). На третий день - ставят тесты для дифференциации
и на лекарственную чувствительность.
При определении
коагулазной активности пользуются лиофилизированной плазмой крови
кролика, разведенной стерильным физиологическим раствором 1:5 и
разлитой в стерильные пробирки по 0,5 мл в каждую. В пробирку
засевают 1 петлю суточной агаровой культуры исследуемого штамма и
помещают в термостат при 37°С. Учет результатов производят через 30
мин, 1 час, 2 часа и 24 часа. Положительными считаются все степени
свертывания плазмы от небольшого сгустка, остающегося неподвижным
при перевертывании пробирки.
Лецитиназная активность
определяется на желточно-солевом агаре. Учет реакции производят
через 24-48 часов макроскопически по наличию мутной зоны и
радужного венчика вокруг колоний стафилококка, что свидетельствует
о наличии у них фермента лецитиназы.
При изучении ферментации
маннита посев суточной агаровой культуры испытуемого штамма
производят уголком в столбик 1% агара с маннитом и вазелиновым
маслом. При ферментации маннита столбик агар синеет. Положительной
считается реакция при ферментации 2/3 столбика агара.
Для определения
пигментообразования культуры стафилококка засевают на 10% молочный
агар. Учет через 18-20 часов.
Определение
гемолитической способности культуры стафилококка осуществляется на
5% кровяном агаре (донорская кровь без добавления антисептиков) по
наличию просветления вокруг выросших колоний, которые четко
выявляются в проходящем свете. Положительный гемолитический тест на
агаре с кровью человека, как правило, обусловлен гемотоксинами,
тогда как основную роль в патогенезе стафилококковых инфекций
играет альфа-токсин, который можно выявить на агаре с кровью
кролика.
Семейство
Streptococcaceae. Стрептококки представляют собой большую и
довольно гетерогенную группу микроорганизмов. Наиболее изученными
являются аэробные представители: Streptococcus pyogenes, S.
faecalis, S. pneumoniae. Микроб имеет сферическую форму,
грамположителен, в мазках с плотных питательных сред располагается
в виде коротких цепочек из 2-3 кокков, на жидких питательных средах
дает более длинные цепочки. При выращивании стрептококков следует
учитывать их повышенную потребность в питательных веществах.
Поэтому для культивирования стрептококка применяют питательные
среды, содержащие глюкозу (1%), кровь (5-10%), сыворотку
(10-20%).
ЗАНЯТИЕ № 4
ТЕМА: ФИЗИОЛОГИЯ МИКРООРГАНИЗМОВ. БАКТЕРИОЛОГИЧЕСКИЙ (КУЛЬТУРАЛЬНЫЙ) МЕТОД ИССЛЕДОВАНИЯ. БИОХИМИЧЕСКИЕ СВОЙСТВА МИКРООРГАНИЗМОВ.
ПЕРЕЧЕНЬ КОНТРОЛЬНЫХ ВОПРОСОВ
Питание бактерий. Питательные вещества – источники углерода и азота. Классификация бактерий по типам питания Аутотрофы и хемоорганотрофы
Факторы роста и их источники. Источники минеральных элементов.
Способы и механизмы переноса питательных веществ через мембрану.
Энергетические потребности бактерий. Пути получения энергии у аутотрофов (фотосинтез, хемосинтез). Источники и пути получения энергии у хемоорганотрофов.
Аэробный и анаэробный типы биологического окисления у бактерий. Аэробные, анаэробные, факультативно анаэробные и микроаэрофильные бактерии. Способы создания анаэробных условий.
Задачи, этапы, преимущества и недостатки бактериологического (культурального) метода исследования.
Рост и размножение микроорганизмов. Способы размножения. Бинарное (простое) деление, механизм. Размножение бактериальных популяций.
Принципы и методы культивирования бактерий. Питательные потребности микробов.
Питательные среды для культивирования бактерий. Требования к питательным средам. Классификация питательных сред.
Условия и техника культивирования бактерий. Техника посева на питательные среды. Закономерности и характер роста бактерий на плотных и жидких питательных средах.
Способы выделения чистых культур аэробных и анаэробных бактерий.
Свойства, используемые для идентификации выделенных культур.
САМОСТОЯТЕЛЬНАЯ И ЛАБОРАТОРНАЯ РАБОТА
Бактериологический метод (этапы):
1 1-й этап выделения чистой культуры аэробных бактерий: А) Микроскопия патологического материала.
Окраска мазков из патологического материала по Граму. Зарисовка препарата.
Б) Освоение под руководством преподавателя техники посева патологического материала бактериологической петлей и шпателем на пластинчатые питательные среды.Посев патологического материала бактериологической петлей на пластинчатый мясопептонный агар (МПА) для получения изолированных колоний.
Классификация питательных сред (указать области применения)
1. По консистенции: жидкие (мясо- пептонный бульон, желчный, сахарный бульон), плотные (2- 3% агара) и полужидкие (0,15- 0,7 % агара) среды.
2. По происхождению: естественные - из молока, мяса. яиц, картофеля, сыворотки крови человека, животных и др продуктов; искусственные – 1) натуральные сбалансированные смеси питательных веществ в концентрациях и сочетаниях, необходимых для роста и размножения микроорганизмов, универсальный источник азота и углерода - пептоны - продукты неполного расщепления белков с помощью пепсина или различные гидролизаты (рыбный, казеиновый, дрожжевой и др.).2) синтетические c точным химическим составом Сотона для микобактерий, 199 для клеток.
3. По составу: простые питательные среды (мясо- пептонный бульон- МПБ, мясо- пептонный агар- МПА) и с ложные (КА = МПА +5- 10% крови животных)
4. По назначению:
А) Общего назначения - универсальные, предназначенные для культивирования любых микроорганизмов (МПА,КА)
Б) Специальные для выращивания микроорганизмов не растущих на универсальных средах, дифференциации видов и избирательного выделения отдельных видов микроорганизмов:
элективные (селективные) для выделения определенных видов микроорганизмов и подавления роста сопутствующих – (солевой агар для стафилококков).
дифференциально-диагностические (ДДС) -среды, позволяющие различать виды бактерий по ферментативной активности; Они с одержат: 1) универсальную питательную среду (МПА, КА); 2)дифферецирующий фактор - химический субстрат (например, углевод), различное отношение к которому является диагностическим признаком для данного микроба.3) Индикатор, изменение цвета которого свидетельствует о биохимической реакции. (среды Эндо, Плоскирева, Гисса и другие).
дифференциально-селективные (ДС) - среды, позволяющие выделять бактерии определенного вида по их физиологическим особенностям и дифференцировать от других видов по ферментативной активности Они содержат: 1) МПА 2) элективный химический субстрат, препятствующий росту других видов бактерий . 3)дифферецирующий фактор - субстрат, отношение к которому является диагностическим признаком для данного микроба;) 4.) Индикатор, изменение цвета которого свидетельствует о биохимической реакции. (среды ЖСА для стафилококков, ВСА для сальмонелл, Плоскирева для шигелл и сальмонелл).
В) Обогащения среды для размножения и накопления бактерий определенного вида в клиническом материале (кровь в 20% желчном бульоне =сальмонеллы, отделяемое зева в 10 % сывороточном+ 2 % теллурита = коринебактерии.)
Г) Транспортные среды для забора и доставки (консервации) клинического материала =48 часов (Среда Амиеса –полужидкий агар+уголь активированный).)
Питательные среды (примеры):
Среда Эндо Тип среды дифференциально-диагностическая для энтеробактерий Питательная основа МПА Дифференцирующий фактор лактоза 1% Индикатор основной фуксин, обесцвеченный сульфитом натрия. Е.с oli разлагают лактозу до кислоты –колонии красные с металлическим блеском, патогенные бесцветные;
Солевой агар Тип среды элективная для выделения стафилококков Питательная основа МПА Элективный фактор хлористый натрий 10%
Среда Плоскирева Тип среды дифференциально-селективная для энтеробактерий
Питательная основа МПА Элективный фактор соли желчных кислот Дифференцирующий фактор лактоза
Индикатор нейтральный красный
Желточно-солевой агар Тип среды дифференциально-селективная для S . aureus _
Питательная основа МПА Элективный фактор хлористый натрий 10%
Дифференцирующий фактор яичный желток
Индикатор нет
2 2 этап бактериологического метода исследования (выделение чистой культуры):
А) Изучение изолированных колоний (эшерихий, стафилококка) на пластинчатом МПА.
|
Изучаемые культуральные свойства |
1 тип колоний |
2 тип колоний |
|
Форма колонии |
Правильной формы, круглые |
Правильной формы |
|
Консистенция |
однородные |
однородные |
|
Размер колонии |
средние (размером 2-4 мм) | |
|
Характер края |
с ровными краями |
с ровными краями |
|
Характер поверхности |
выпуклые |
Б) Приготовление мазков из отобранных колоний (окраска по Граму).
В) Пересев изолированных колоний на скошенный МПА для накопления чистой культуры.
3 Выделение чистой культуры анаэробных бактерий: посев суспензии почвы на среду Китта-Тароцци для выделения патогенных клостридий
Среда Китт- Тароцци состоит из питательного бульона, 0,5% глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 - 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина
Методы создания анаэробиоза:
1.Физический- откачивание воздуха, введение специальной газовой безкислородной смеси (чаще- N 2 - 85%, CO 2 - 10%, H 2 - 5%), предварительное кипячение питательных сред, посев в глубокий столбик агара, заливка сред вазелиновым маслом для сокращения доступа кислорода, использование герметически закрывающихся флаконов и пробирок, шприцев и лабораторной посуды с инертным газом, использование плотно закрывающихся эксикаторов с горящей свечой
2. Химический- применяют химические поглотители кислорода.
3. Биологический - совместное культивирование строгих аэробов и анаэробов (аэробы поглощают кислород и создают условия для размножения анаэробов – метод Фортнера).
Среда Китт - Тароцци состоит из питательного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 - 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
4. Смешанный - используют несколько разных подходов.
Используются специальные приборы для создания анаэробных условий - анаэростаты. В настоящее время наиболее простым и эффективным оборудованием для создания анаэробных и микроаэрофильных условий является химический метод со специальными пакетами, действующими по принципу поглощения атмосферного кислорода в герметически закрытых емкостях .
Среда Вильсона-Блера (пробирки,чашки):
Питательная основа МПА Дыхательный субстрат глюкоза
Редуцирующий фактор сульфит натрия и двуххлористое железо сульфит-натрия Na 2 SO 3 → Na 2 S
Для среды Вильсона - Блера базой является агар с добавлением глюкозы , Клостридии образуют на этой среде колонии чёрного цвета за счет восстановления сульфита до сульфид - аниона , который соединяясь с катионами железа (II) дает соль чёрного цвета. Как правило, черные на этой среде образования колонии , появляются в глубине агарового столбика .
Тиогликолевая среда (среда для контроля стерильности): (пробирки):
Питательная основа МПБ Дыхательный субстрат глюкоза Редуцирующий фактор тиогликолят натрия
Индикатор резазурин
Глюкозо-кровяной агар Цейсслера: (чашки): Питательная основа МПА, кровь
Дыхательный субстрат глюкоза Редуцирующий фактор гемоглобин
Термин «анаэробы» ввел Луи Пастер , открывший в 1861 году бактерии маслянокислого брожения .
А Лекция 3 Физиология микроорганизмов. Метаболизм бактерий .
Физиология микроорганизмов включает:
типы питания;
типы дыхания;
культивирование (условия, среды, характер и скорость роста);
биохимическую активность;
изменчивость;
выделение биологически активных веществ, токсинов и других факторов патогенности;
чувствительность к антибиотикам, бактериофагам, бактериоцинам;
другие биологические свойства.
Метаболизм бактерий – совокупность физико-химических процессов (химических превращений и реакций), направленных на воспроизводство структур и обеспечение жизненных функций микробной клетки, таких как:
рост и размножение;
отложение резервного пищевого материала;
транспорт питательных веществ в микробную клетку;
выделение продуктов метаболизма (токсинов, ферментов, антибиотиков и других биологически активных веществ);
движение;
спорообразование;
адгезия на чувствительных рецепторах клеток хозяина и проникновение в них;
различных адаптивных реакций на изменение внешней среды.
Анаболизм - совокупность биохимических реакций, осуществляющих синтез компонентов клетки.
Катаболизм - совокупность реакций, обеспечивающих клетку энергией.
Схема изучения метаболизма – этапы:
1. Начальный (периферический) метаболизм – проникновение веществ в клетку извне и распад до промежуточных продуктов.
2. Амфиболизм (промежуточный метаболизм) – образование промежуточных продуктов метаболизма, общих для катаболических и анаболических путей.
3. Конечные, строго специализированные этапы конструктивного метаболизма (ведут к построению структур клетки) и энергетического метаболизма (образование АТФ).
Механизмы проникновения питательных веществ в клетку:
Простая диффузия (для истинных растворов). Энергонезависимый процесс.
Облегченная диффузия («паром по течению») – в направлении градиента концентрации с участием белков – переносчиков. Энергозависимый процесс.
Активный транспорт – против концентрационного и электрохимического градиента с участием пермеаз (амино-, оксикислотных, ионных и др.). Процесс идет с затратой энергии АТФ, зависит от заряда веществ и их трансформации в процессе переноса.
Микроорганизмы по способности усваивать источники углерода делятся на две группы: автотрофы (лат. autos - сам,trophe - питание) синтезируют все углеродсодержащие компоненты клетки из СО 2 как единственного источника углерода и гетеротрофы (лат.heteros - другой, «питающийся за счет других») используют разнообразные органические углеродсодержащие соединения.
В зависимости от источников энергии и микроорганизмы подразделяют на фототрофы (фотосинтезирующие), способные использовать солнечную энергию, и хемотрофы (хемосинтезирующие), получающие энергию за счет окислительно-восстановительных реакций.
В зависимости от используемых доноров электронов бактерии разделяют на литотрофы (используют неорганические доноры электронов) и органотрофы (используют органические соединения).
Прототрофы - микроорганизмы, способные синтезировать все необходимые им органические соединения из глюкозы и солей аммония.
Ауксотрофы - микроорганизмы, не способные синтезировать какие-либо органические соединения. Они получают эти соединения в готовом виде из окружающей среды или организма человека.
Ферменты (от греч.fermentum-закваска) -высокоспецифические белковые катализаторы, присутствующие во всех живых клетках, без которых не возможны жизнь и размножение. Ферменты распознают соответствующие им метаболиты (субстраты), вступают с ними во взаимодействие и ускоряют химические реакции. Ферменты являются белками.
Ферментный состав микроорганизма определяется геномом и является достаточно стабильным признаком. Определение ферментов широко применяется для биохимической идентификации бактерий.
Эндоферменты катализируют метаболизм проходящий внутри клетки.
Экзоферменты выделяются клеткой в окружающую среду.
Конститутивные ферменты постоянно синтезируются в определенных концентрациях.
Индуцибельные ферменты – это ферменты, концентрация которых увеличивается при поступлении соответствующего субстрата.
Ферменты агрессии: гиалуронидаза, фибринолизин, нейраминидаза, коллагеназа, лецитиназа (лицитовителлаза), коагулаза, уреаза, аминокислотные декарбоксилазы, дезоксирибонуклеаза.
Культивирование – получение культур микроорганизмов в условиях искусственной питательной среды.
Цели культивирования:
получение чистых культур патогенных микроорганизмов и их идентификация;
накопление биомассы продуцентов БАВ (витаминов, гормонов, аминокислот, антибиотиков и др.);
получение диагностических и профилактических препаратов (вакцин, диагностикумов);
хранение эталонных музейных культур;
в санитарной микробиологии для определения санитарно-показательных микроорганизмов – индикаторов загрязненности окружающей среды.
Культура – популяция микроорганизмов, выращенная на питательной среде.
Чистая культура – популяция одного вида микроорганизмов, выращенная из изолированной колонии на питательной среде.
Большинство патогенных микробов выращивают на питательных средах при температуре 37°С в течение 1-2 сут.
Классификация питательных сред
По консистенции: жидкие, полужидкие, плотные.
По происхождению: естественные (молоко, картофель), искусственные, полусинтетические, синтетические
По составу: простые (МПА, МПБ, овощи, молоко), сложные (1% глюкозы, 10-20% сыворотки крови, 20-30% асцитической жидкости,5-10% дефибринированной крови).
По назначению:
универсальные - среды, на которых хорошо растут многие виды бактерий. К ним относятся мясо-пептонный бульон (МПБ) и мясо-пептонный агар (МПА);
специальные - среды, специально приготовленные для получения роста бактерий, которые не растут на универсальных средах;
дифференциально-диагностические - среды, позволяющие отличать одни виды бактерий от других по ферментативной активности;
селективные - среды, содержащие вещества, используемые микроорганизмами определенных видов и препятствующие росту других микроорганизмов. Селективные среды позволяют направленно отбирать из исследуемого материала определенные виды бактерий;
дифференциально-селективные - среды, сочетающие в себе свойства дифференциально-диагностических и селективных сред;
консервирующие;
обогатительные.
Размножение бактерий на жидких и плотных питательных средах.
Рост координированное воспроизведение всех компонентов бактериальной клетки и увеличение ее биомассы.Размножение – воспроизводство и увеличение количества клеток, приводящее к образованию бактериальной популяции.
Бактерии характеризуются высокой скоростью размножения. Скорость размножения зависит от видовой принадлежности, состава питательной среды, рН, температуры, аэрации.
На плотных питательных средах бактерии образуют скопления клеток, называемые колониями. Колонии разных видов отличаются по размерам, форме, консистенции, окраске, характеру краев, характеру поверхности, прозрачности.
Характер роста на жидких питательных средах: пленочный (образованием пленки на поверхности питательной среды), диффузное помутнение, придонный (образование осадка).
Фазы развития бактериальной популяции
Исходная стационарная фаза (~ 1-2 ч.). Число бактерий не увеличивается, клетки не растут.
Лаг-фаза или фаза задержки размножения (~ 2ч.).
Log-фаза - логарифмическая или экспоненциальная фаза (~ 3-5ч). Популяция делится с максимальной скоростью и идет увеличение особей в геометрической прогрессии.
Фаза отрицательного ускорения (~ 2ч.). Связана с истощением лимитирующего метаболита или накоплением токсических продуктов метаболизма.
Стационарная фаза максимума. Количество образующихся и отмирающих клеток одинаково.
Фаза ускоренной гибели (~ 3 ч.).
Логарифмическая фаза гибели (~ 5).
Фаза уменьшения скорости отмирания – остающиеся живые особи переходят в состояние покоя.
Энергетический метаболизм бактерий
Аэробы - микроорганизмы, использующих аэробный (окислительный) тип биологоческого окисления субстратов. Метаболизм аэробов осуществляется только при наличии в среде обитания высокой концентрации свободного кислорода, который выполняет функцию конечного акцептора отнятых от субстрата электронов. Культивирование аэробов осуществляют на средах с полным доступом кислорода воздуха.
Облигатные анаэробы - микроорганизмы, использующая анаэробный тип биологического окисления (брожение). Метаболизм осуществляется только в средах с низким окислительно-востановительным потенциалом при отсутствии кислорода.
Повышение концентрации кислорода в среде ведет к гибели вегетативных форм.
Количество извлекаемой в процессе брожения энергии невелико, поэтому облигатные анаэробы вынуждены сбраживать большое количество субстрата.
Факультативные анаэробы - микроорганизмы, способные извлекать энергию из субстратов аэробным (окислительным) и анаэробным (бродильным) путями биологического окисления. Метаболизм может осуществляться как в условиях полного доступа кислорода в среду, так и в условиях анаэробиоза.
Методы создания анаэробиоза
Физические
посев в столбик сахарного МПА;
кипячение (регенерация) жидких питательных сред с последующим масляным покрытием;
механическое удаление кислорода в анаэростатах;
замена кислорода индиферентным газом;
трубки Вейона-Виньяля.
Химические
аппарат Аристовского;
свеча Омелянского (щелочной р-р пирогаллола);
использование химических акцепторов кислорода: глюкозы, пировиноградной кислоты, муравьинокислого натрия и др.
Биологические
среда Китта-Тароцци
метод Фортнера
Анаэробы - организмы, получающие энергию при отсутствии доступа кислорода путем субстратного фосфорилирования , конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ в присутствии конечного акцептора протонов организмами, осуществляющими .
Анаэробное дыхание - совокупностьбиохимических реакций , протекающих в клетках живых организмов при использовании в качестве конечного акцептора протонов некислорода , а других веществ (например,нитратов ) и относится к процессамэнергетического обмена (катаболизм ,диссимиляция ), которые характеризуютсяокислением углеводов ,липидов иаминокислот до низкомолекулярных соединений.
А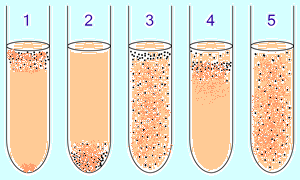 эробные
и анаэробные бактерии предварительно
идентифицируются в жидкой питательной
среде по градиенту концентрации O2:
эробные
и анаэробные бактерии предварительно
идентифицируются в жидкой питательной
среде по градиенту концентрации O2:
1. Облигатные аэробные (нуждающихся в кислороде) бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии - рост пленкой на поверхности из-за восколипидной мембраны.)
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста). 3.Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является наиболее выгодным, чем гликолиз), однако они могут быть найдены на всем протяжении среды, так как от O 2 не зависят. 4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум - малая концентрация кислорода. 5.Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Д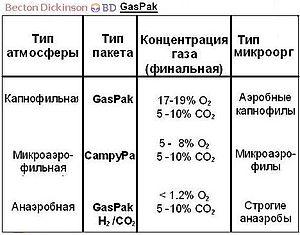 ля
измеренияпотенциала
средыМ.
Кларк
предложил использовать
величину pH20 - отрицательныйлогарифм
парциального
давления
газообразноговодорода
.
Диапазон характеризует все степени
насыщения водного раствора водородом
и кислородом. Аэробы растут при более
высоком потенциале , факультативные
анаэробы , а облигатные - при
наиболее низком .)
ля
измеренияпотенциала
средыМ.
Кларк
предложил использовать
величину pH20 - отрицательныйлогарифм
парциального
давления
газообразноговодорода
.
Диапазон характеризует все степени
насыщения водного раствора водородом
и кислородом. Аэробы растут при более
высоком потенциале , факультативные
анаэробы , а облигатные - при
наиболее низком .)
Классификация анаэробов , различают:
Факультативные анаэробы
Капнеистические анаэробы и микроаэрофилы
Аэротолерантные анаэробы
Умеренно-строгие анаэробы
Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам .
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа - B. abortus)
Применение бактериологического метода дает возможность выделить возбудителя в чистой культуре из материала, полученного от больного, и идентифицировать его на основании изучения комплекса свойств. Большинство бактерий способны к культивированию на различных искусственных питательных средах (кроме хламидий и риккетсий), поэтому бактериологический метод имеет важное значение в диагностике многих инфекционных болезней.
В случае получения положительного результата бактериологический метод позволяет определить чувствительность выделенного возбудителя к антимикробным препаратам. Однако эффективность указанного исследования зависит от многих параметров, в частности от условий сбора материала и его транспортировки в лабораторию.
К основным требованиям , предъявляемым к отбору и транспортировке материала для бактериологического исследования, относят:
- взятие материала до начала этиотропного лечения;
- соблюдение условий стерильности при сборе материала;
- техническую правильность сбора материала;
- достаточное количество материала;
- обеспечение температурного режима хранения и транспортировки материала;
- сведение к минимальному промежутка времени между сбором материала и посевом на плотные питательные среды.
Транспортировка материала в лабораторию должна быть осуществлена по возможности немедленно, но не более чем в течение 1—2 ч после его взятия. Пробы материала должны находиться при определенном температурном режиме; в частности, стерильные в норме материалы (кровь, спинномозговая жидкость) хранят и доставляют в лабораторию при 37 °С. Нестерильные материалы (моча, отделяемое дыхательных путей и др.) хранят при комнатной температуре не более 1-2 ч или не более суток при 4 °С (условия бытового холодильника). При невозможности доставки проб в лабораторию в регламентированные сроки рекомендуют использовать транспортные среды, предназначенные для сохранения жизнеспособности возбудителей в условиях консервации.
Кровь для исследования следует брать у больного в период подъема температуры тела, в начале появления лихорадки. Рекомендуется исследовать 3-4 пробы крови, взятые с интервалом 4-6 ч, что обоснованно с точки зрения снижения риска «упустить» транзиторную бактериемию и повышения возможности подтвердить этиологическую роль выделенной из крови условно-патогенной микрофлоры, если эта микрофлора обнаруживается в нескольких пробах венозной крови. Пробу крови в количестве 10 мл у взрослого и 5 мл у детей засевают минимум в два флакона со средой для аэробных и анаэробных микроорганизмов в соотношении 1:10. Желательно однократное исследование и артериальной крови.
Взятие спинномозговой жидкости (СМЖ) производит врач при люмбальной пункции в количестве 1-2 мл в сухую стерильную пробирку. Пробу немедленно доставляют в лабораторию, где к ее исследованию приступают также немедленно. При отсутствии такой возможности материал сохраняется при 37 °С в течение нескольких часов. Существенно повышает количество положительных результатов бактериологического исследования посев 1-2 капель СМЖ в пробирку, содержащую полужидкую среду с глюкозой, и в чашку Петри с «кровяным» агаром. Для пересылки материала используют изотермальные ящики, грелки, термосы или любую другую упаковку, где поддерживается температура около 37 °С.
Испражнения для бактериологического исследования отбирают с помощью стерильных деревянных шпателей в количестве 3-5 г в стерильный сосуд с плотно закрывающейся крышкой. Исследование взятого материала должно быть начато не позже чем через 2 ч. Если невозможно приступить к исследованию в течение этого времени, следует отобрать небольшое количество материала, который помещают в соответствующую транспортную среду. При отборе испражнений следует стремиться направлять для исследования патологические примеси (слизь, гной, частицы эпителия и др.), если они имеются, избегая попадания в материал примеси крови, обладающей бактерицидными свойствами.
Для взятия материала могут быть использованы ректальные тампоны (с ватным наконечником). Тампон должен быть увлажнен стерильным изотоническим раствором натрия хлорида или транспортной средой (но не масляным гелем). Его вводят per rectum на глубину 5-6 см и, поворачивая тампон, осторожно его извлекают, контролируя появление на тампоне фекальной окраски. Тампон помещают в сухую пробирку, если к исследованию материала приступят в течение 2 ч, в ином случае - в транспортную среду.
Мочу (средняя порция свободно выпущенной мочи) в количестве 3-5 мл собирают в стерильную посуду после тщательного туалета наружных половых органов. Предпочтительней отбирать утренние порции мочи.
Желчь собирают во время дуоденального зондирования в процедурном кабинете отдельно по порциям А, В и С в три стерильные пробирки, соблюдая правила асептики.
Промывные воды желудка собирают в стерильные банки в количестве 20-50 мл. Следует иметь в виду, что промывание желудка в этих случаях проводят только индифферентными (не обладающими бактериостатическим или бактерицидным действием на микроорганизмы) растворами - лучше кипяченой водой (без добавления соды, перманганата калия и пр.).
Мокрота . Утреннюю мокроту, выделяющуюся во время приступа кашля, собирают в стерильную банку. Перед откашливанием больной чистит зубы и полощет рот кипяченой водой с целью механического удаления остатков пищи, слущенного эпителия и микрофлоры ротовой полости.
Промывные воды бронхов . При бронхоскопии вводят не более 5 мл изотонического раствора натрия хлорида с последующим его отсасыванием в стерильную пробирку.
Отделяемое глотки, ротовой полости и носа . Материал из ротовой полости берут натощак или через 2 ч после еды стерильным ватным тампоном либо ложечкой со слизистой оболочки и ее пораженных участков у входов протоков слюнных желез, поверхности языка, из язвочек. При наличии пленки последнюю снимают стерильным пинцетом. Материал из носовой полости забирают сухим стерильным ватным тампоном, который вводят в глубь полости носа. Материал из носоглотки берут стерильным заднеглоточным ватным тампоном, который осторожно вводят через носовое отверстие в носоглотку. Если при этом начинается кашель, тампон не удаляют до окончания кашля. Для проведения анализа на дифтерию исследуют одновременно пленки и слизь из носа и глотки, беря материал разными тампонами.
Исследуемый материал засевают на плотные питательные среды, используя специальные методики для получения роста отдельных колоний микроорганизмов, которые далее отсевают с целью выделения чистой культуры возбудителя.
Определенные виды бактерий выделяют, используя элективные (избирательные) среды, которые задерживают рост посторонних микроорганизмов или содержат вещества, стимулирующие рост определенных патогенных микробов.
Выделенные на питательных средах микроорганизмы идентифицируют , т.е. определяют видовую или типовую их принадлежность. В последнее время для идентификации в практике здравоохранения используют микротест-системы, представляющие собой панели с набором дифференциально-диагностических сред, что ускоряет исследование. Микротест-системы применяют и для определения чувствительности микроорганизмов к антимикробным препаратам методом разведения антибиотика в жидкой питательной среде.
Оценивая результаты бактериологического исследования, врач должен учитывать, что отрицательный результат не всегда означает отсутствие возбудителя и может быть связан с применением антимикробных препаратов, высокой микроцидной активностью крови, техническими погрешностями. Обнаружение патогенного микроба в материале от больного вне связи с клинической картиной возможно в случае реконвалесцентного, здорового или транзиторного бактерионосительства.
Выделение из крови при соблюдении всех правил асептики условно-патогенных микроорганизмов (эпидермальный стафилококк, кишечная палочка) и даже сапрофитов следует считать проявлением бактериемии, особенно если эти микробы обнаружены больше чем в одной пробе материала или в разных субстратах (кровь, моча), поскольку при снижении иммунореактивности организма эти и другие «непатогенные» микроорганизмы могут быть возбудителями инфекционных процессов, в том числе и сепсиса.
Определенную сложность представляет трактовка результатов бактериологического исследования нестерильных сред , а именно доказательство этиологической роли условно-патогенных микроорганизмов. В этом случае учитывают в комплексе такие показатели, как вид выделенных культур, количество микробных клеток данного вида в материале, повторное их выделение в течение заболевания, присутствие монокультуры или ассоциации микроорганизма.
Ющук Н.Д., Венгеров Ю.Я.
Методика бактериологического исследования . Выделение возбудителя из крови (гемокультура) является ранним методом диагностики заболеваний. Бактериемия у больных тифо-паратифозным заболеванием появляется в конце инкубационного периода и не исчезает в течение всего лихорадочного периода болезни и во время рецидивов. Результаты бактериологического исследования в определенной степени зависят от сроков взятия материала и от количества засеваемой крови. Чем раньше от начала болезни произведен посев крови, тем больше вероятность обнаружения возбудителя. На первой неделе брюшного тифа кровь у больного берут из локтевой вены в количество 10 мл, в более поздние сроки и во время рецидивов - 20 мл.
В первый день исследования кровь засевают в соотношении 1:10 в одну из жидких сред. Указанное соотношение необходимо точно соблюдать, так как при меньшем разведении крови микробы могут погибнуть из-за бактерицидного ее действия. Для посева пользуются: 10% или 20% раствором желчного бульона, разлитого по 50-100 мл во флаконы, мясо-пептонным бульоном с добавлением 1 % глюкозы, стерильной дистиллированной водой - по методу Н. Н. Клодницкого, в которой происходит лизис эритроцитов, продукты их распада при этом служат хорошей питательной средой для размножения бактерий. Можно также использовать стерильную водопроводную воду. Лучшие результаты получаются при посевах материала на желчный бульон. Если невозможно произвести посев крови на месте, сыворотку вместе со сгустком или цитратную кровь (10 мл крови выливают в пробирку с 2 мл 5% стерильного натрия цитрата) направляют в лабораторию. Сгусток крови в лаборатории измельчают и засевают в одну из перечисленных сред. Флаконы помещают в термостат при температуре 37° С.
Второй день исследования . Через 14-24 ч от начала исследования производят посев материала в чашку Петри на среду Эндо или среду с эозином и метиленовым синим (среда Левина). Не рекомендуют использовать для посева среду Плоскирева, так как тифо-паратифозные палочки, находящиеся в крови, являются по типу питания облигатными паратрофами и не сразу меняют этот тип питания на метатрофный (то есть мертвыми органическими субстратами). Поэтому на этой среде, содержащей соли желчных кислот, палочки брюшного тифа растут очень плохо либо совсем не растут. При отсутствии роста бактерий после первого посева производят последующие через 48, 72 ч и на 5-е и 10-е сутки. Если при этом возбудитель выделить не удалось, выдается отрицательный ответ. В сомнительных случаях рекомендуют периодически - 1 раз в 3-4 дня - производить посевы до 24-го дня с момента взятия материала. Отрицательный ответ выдается все же на 7-й день.
Третий день исследования . Выросшие на средах Эндо и Левина «подозрительные» колонии (на среде Эндо колонии патогенных микробов бесцветны) идентифицируют, для чего 2-3 колонии пересевают на скошенный агар и среду Ресселя.
Четвертый день исследования . Учитывают и регистрируют результаты посева на среде Ресселя, изучают морфологические свойства выделенных культур в мазке, окрашенном по Граму. Определяют подвижность - наличие или отсутствие жгутиков - в висячей или раздавленной капле, взятой из 4-6-часовой бульонной культуры. Для этого агаровую культуру (одну петлю) засевают в 1 мл слегка подогретого бульона. Пересевают отобранные культуры (2-3 пробирки) на среды Гисса с маннитом, сахарозой и косой агар, а также в 2 пробирки с мясо-пептонным бульоном, в которые под пробки помещают полоски фильтровальной бумаги, смоченные специальными растворами для определения сероводорода и индола (развернутый «пестрый ряд»).
Пятый день исследования . Регистрируют изменения на развернутом «пестром ряду». При наличии газообразования ставят реакцию агглютинации со смесью сальмонеллезных сывороток. При положительной реакции проводят реакцию агглютинации с О- и Н-сыворотками и выдают окончательный ответ на основании совокупности всех признаков.
Выделение миелокультуры осуществляют путем посева полученного пунктата костного мозга в 3-5 мл бычьей стерильной желчи или в 25-30 мл 10% желчного бульона, ставят его в термостат и на следующий день производят пересев на среды Эндо или Вильсона - Блера. В дальнейшем этапы исследований те же.
Выделение бактерий из кала. С 8- 10-го дня болезни, чаще с третьей недели, у больных брюшным тифом, паратифами выделяются с испражнениями бактерии. Для исследования берут последние порции кала жидкой консистенции, эмульгируют в изотоническом растворе натрия хлорида (в соотношении 1:10) и оставляют на 30 мин до оседания крупных частиц. Для посева каплю материала берут с поверхности жидкости.
В первый день исследования материал засевают на среды обогащения - желчный бульон, среды магниевую, Мюллера, Кауфмана - и ставят в термостат. На второй день исследования со среды обогащения делают посев на чашки со средами Плоскирева, Эндо или Левина и Вильсона - Блера (висмут-сульфит-агар). В последующем этапы исследования те же, что при выделении гемокультуры.
Выделение бактерий тифо-паратифозной группы из мочи лучше производить со второй третьей недели болезни. Перед взятием материала следует обмыть стерильным изотоническим раствором натрия хлорида наружное отверстие мочеиспускательного канала; у женщин лучше брать мочу катетером. Для исследования берут 20-30 мл мочи. После центрифугирования осадок засевают в 2 чашки со средой Плоскирева или висмут-сульфит-агаром. Надосадочную жидкость засевают на среду обогащения (10% желчный бульон) и ставят в термостат на 24 ч, после чего производят посев в 2 чашки одной из элективных сред. Выделенные колонии идентифицируют обычным способом.
Исследование дуоденального содержимого - желчи. Метод чаще применяют в стадии реконвалесценции. Желчь собирают во время зондирования в стерильные пробирки. Дуоденальное содержимое засевают во флаконы с 50 мл бульона, а оставшуюся часть материала вместе с посевами помещают в термостат при 37° С. На следующий день делают посев в 2 чашки с плотной дифференциальной средой. Выделенные колонии идентифицируют по описанной методике.
Высокочувствительным и перспективным в ранней диагностике брюшного тифа и паратифов является метод иммунофлюоресценции, с помощью которого исследуют кровь с первых дней болезни, кал с 10-го дня, дуоденальное содержимое на 10-й день нормальной температуры тела. Специфическими флюоресцирующими сыворотками маркируют тифо-паратифозные бактерии, которые в последующем определяют при люминесцентной микроскопии. Метод позволяет диагностировать заболевание через 10-12 ч от начала исследования.
Серологическая диагностика тифо-паратифозных заболеваний. Со второй недели заболевания в крови больных появляются специфические антитела, которые можно определить с помощью реакции Видаля. При брюшном тифе и паратифах накапливаются О-, а затем и Н-агглютинины. В течение заболевания иногда обнаруживают и Vi-агглютинины, но последние, в отличие от но-сительства, не имеют диагностического значения. Определение в крови больных специфических агглютининов к возбудителю брюшного тифа и паратифов (реакция Видаля) может оказать помощь в установлении диагноза как в остром периоде болезни, так и во время реконвалесценции.
При сальмонеллезах реакция Видаля является подсобным методом диагностики. Следует помнить, что нередко встречаются формы болезни со слабо выраженным иммунологическим ответом. Особенно часто низкие титры агглютининов, вплоть до их отсутствия, отмечают у больных, леченных антибиотиками.
Для реакции Видаля берут 1-3 мл крови из пальца или локтевой вены в стерильную пробирку. С целью ускорения свертывания крови ее ставят в термостат на 30 мин. Свернувшуюся кровь обводят стеклянной пипеткой и помещают в холодильник до появления прозрачной отстоявшейся сыворотки. Сгусток используют для посева (гемокультура). Реакцию агглютинации ставят с Н- и О-брюшнотифозными, А- и В-паратифозными диагностикумами. Сыворотку разводят, начиная с титра 1:100 до 1:800, по следующей методике. В пробирку наливают 9,9 мл стерильного изотонического раствора натрия хлорида и 0,1 мл испытуемой сыворотки - получают разведение 1:100. В 4 опытные пробирки (по числу антигенов, используемых в реакции Видаля), и в одну, служащую контролем сыворотки, разливают 5 мл разведенной сыворотки по 1 мл. Из оставшихся 5 мл сыворотки (разведения 1:100) 1 мл выливают, а к 4 мл добавляют 4 мл изотонического раствора натрия хлорида и получают разведение 1:200. 4 мл из разведения 1:200 разливают также в 4 пробирки по 1 мл, а к оставшимся 4 мл вновь добавляют 4 мл изотонического раствора натрия хлорида для получения разведения 1:400. Последующие разведения (1:800, 1:1600) производят описанным способом. В 4 пробирки, являющиеся контролем антигенов, вливают по 1 мл изотонического раствора хлорида натрия. Во все опытные пробирки, исключая, те, которые служат контролем сыворотки, вливают по 1-2 капли соответствующих диагностикумов. Штатив с пробирками встряхивают и помещают в термостат при 37° С на 24 ч. Н-агглютинация (крупнохлопчатая) наступает через 2 ч, О-агглютинация (мелкозернистая) - значительно позже. Интенсивность реакции отмечают через 24 ч. Диагностический титр реакции Видаля в разведении не менее чем 1:200 при наличии клинических проявлений.
Следует учитывать, что эта реакция может быть положительной при других заболеваниях - туберкулезе, малярии, бруцеллезе, злокачественных новообразованиях и некоторых состояниях (беременности). Реакция Видаля может быть положительной и у здоровых лиц (бытовая реакция), у привитых и перенесших в прошлом заболевание (анамнестическая реакция). Для повышения специфичности реакции Видаля Фишер предложил разводить сыворотку гипертоническим раствором натрия хлорида (2,9 и 5,8%). Это приводит к ослаблению или ликвидации групповых реакций. Ценность реакции агглютинации повышается при повторных исследованиях, когда с динамикой заболевания устанавливают нарастание титра антител. При паратифе А реакция Видаля может быть отрицательной либо титр специфических антител меньше групповых.
В последние годы для распознавания кишечной группы заболеваний широко применяют реакцию пассивной гемагглютинации (РПГА) с парциальными антигенами брюшнотифозных бактерий. РПГА отливается высокой чувствительностью и специфичностью, бывает положительной с 5-го дня болезни. Минимальный диагностический титр у больных брюшным тифом, паратифами, сальмонеллезом с О-антигеном - 1:200. Реакцию ставят в динамике для определения нарастания титра антител.
Методы лабораторной диагностики бактерионосительства при брюшном тифе и паратифах. Бактериологическое исследование кала, мочи и дуоденального содержимого проводят по общепринятым методам. Лучшие результаты получают при использовании селенитовых сред.
В связи с периодичностью выделения бактерий нередко не удается высеять возбудителя. У подавляющего большинства носителей палочек брюшного тифа обнаруживают микробы, содержащие Vi-антиген, в связи с чем в крови острых и хронических носителей появляются Vi-антитела (в крови больных они бывают реже). Диагностический титр реакции 1:20 и выше. Параллельно с реакцией Vi-агглютинации (с прогретой сывороткой) ставится реакция Видаля (с нативной сывороткой) с Н- и О-брюшнотифозными диагностикумами. В сыворотках брюшнотифозных бактерионосителей Н-антитела в титре от 1:200 до 1:800 встречаются в 60-80% случаев. Наличие сочетания Н- и Vi-антител имеет особое диагностическое значение в выявлении носителей палочек брюшного тифа.
Из дополнительных методов исследования для выявления носительства палочек брюшного тифа применяют кожно-аллергическую пробу с тифином, а также РПГА с Vi-антигеном.
Таким образом, важным условием успеха борьбы с тифо-паратифозными заболеваниями является раннее и полное выявление и обезвреживание источника инфекций. В настоящее время брюшной тиф встречается спорадически. При этом течение болезни менее длительное и не сопровождается всеми типичными для классической формы признаками, что затрудняет клиническое распознавание.
В связи с изложенным комплексное лабораторное обследование приобретает важное значение.
Бактериологический метод исследования (БЛМИ) – метод, основанный на выделении чистых культур бактерий с помощью культивирования на питательных средах и их идентификации до вида на основании изучения морфологических, культуральных, биохимических, генетических, серологических, биологических, экологических характеристик микроорганизмов.
Бактериологическую диагностику инфекций проводят, используя стандартные диагностические схемы, утвержденные Министерством здравоохранения.
Чистая культура – бактерии одного вида, выращенные на питательной среде, свойства которых находятся в процессе изучения.
Штамм – идентифицированная чистая культура микроорганизмов одного вида, выделенная из определенного источника в определенное время. Штаммы одного вида могут несущественно отличаться биохимическими, генетическими, серологическими, биологическими и др. свойствами, а также местом и временем выделения.
Цели БЛМИ:
1. Постановка этиологического диагноза: выделение чистой культуры микроорганизмов и её идентификация.
2. Определение дополнительных свойств, например, чувствительности микроорганизма к антибиотикам и бактериофагам.
3. Определение количества микроорганизмов (важно в диагностике инфекций, вызываемых УПМ).
4. Типирование микроорганизмов, т. е. определение внутривидовых различий на основании изучения генетических и эпидемиологических (фаговаров и сероваров) маркёров. Это используется в эпидемиологических целях, т. к. позволяет установить общность микроорганизмов, выделяемых от разных больных и из разных объектов внешней среды, в различных стационарах, географических регионах.
БЛМИ включает несколько этапов, различных для аэробов, факультативных анаэробов и облигатных анаэробов.
I. Этапы БЛМИ при выделении чистой культуры аэробов и факультативных анаэробов.
Этап.
А.Забор, транспортировка, хранение, предварительная обработка материала. Иногда до посева проводят селективную обработку материала с учетом свойств выделяемого микроорганизма. Например, перед исследованием мокроты или другого материала на присутствие кислотустойчивых микобактерий туберкулеза, материал обрабатывают растворами кислот или щелочей.
Б. Посев в среду обогащения (при необходимости).Его проводят, если в исследуемом материале содержится малое количество бактерий, например, при выделении гемокультуры. Для этого кровь, взятую на высоте лихорадки в большом объёме (8–10 мл у взрослых, 4–5 мл у детей) засевают в среду в соотношении 1:10 (для преодоления действия бактерицидных факторов крови); посев инкубируют при температуре 37 0 С 18-24 ч.
В. Микроскопия исследуемого материала. Из исследуемого материала готовят мазок, окрашивают его по Граму или другим методом и микроскопируют. Оценивают присутствующую микрофлору, ее количество. В ходе дальнейших исследований должны быть выделены микроорганизмы, присутствовавшие в первичном мазке.
Г. Посев на питательные среды с целью получения изолированных колоний. Производят посев материала петлёй или шпателем методом механического разобщения на чашку с дифференциально-диагностической или селективной средой с целью получения изолированных колоний. После посева чашку переворачивают дном кверху (чтобы избежать размазывания колоний капельками конденсационной жидкости), подписывают и помещают в термостат при температуре 37 0 С на 18-24 ч.
Следует помнить, что при посевах и пересевах микробных культур внимание работающего должно быть обращено на соблюдение правил асептики для предупреждения контаминации питательных сред и предупреждения заражения окружающих и самозаражения!
В случае инфекций, вызываемых условно-патогенными микроорганизмами, где имеет значение количество присутствующих микроорганизмов в патологическом материале, делают количественный посев материала, для чего предварительного готовят ряд 100-кратных разведений материала (обычно 3 разведения) в стерильном изотоническом растворе хлорида натрия в пробирках. После чего по 50 мкл каждого разведения высевают на питательные среды в чашках Петри.
Этап.
А. Изучение морфотипов колоний на средах, их микроскопия. Просматривают чашки и отмечают оптимальную питательную среду, скорость роста, характер роста микроорганизмов. Для изучения выбираютизолированные колонии, расположенные по ходу штриха, ближе к центру. Если вырастает несколько типов колоний – каждый исследуется в отдельности. Оценивают признаки колоний (табл. 7). При необходимости чашки с посевамипросматривают через лупу или с помощью микроскопа с объективом малого увеличения и суженной диафрагмой. Изучают тинкториальные свойства отличающихся морфотипов колоний, для этого из части исследуемой колонии готовят мазок, окрашивают по Граму или другими методами, микроскопируют и определяют морфологию чистоту культуры.При необходимости ставят ориентировочную РА на стекле с поливалентными сыворотками.
Б. Накопление чистой культуры. Для накопления чистой культуры изолированные колонии всех морфотипов пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой и инкубируют в термостате при +37 0 С (такая температура оптимальна для большинства микроорганизмов, но может быть и другой, например, для Campylobacterium spp. – +42 0 C, Candida spp. и Yersinia pestis – +25 0 C).
В качестве среды накопления для энтеробактерий обычно используют среду Клиглера.
Состав среды Клиглера: МПА, 0,1% глюкозы, 1% лактозы, реактив на сероводород (сернокислое железо + тиосульфат натрия + сульфит натрия), индикатор феноловый красный. Изначальный цвет среды малиново-красный, среда «скошена» в пробирках: имеет столбик (2/3) и скошенную поверхность (1/3).
Посев в среду Клиглера производится штрихом по поверхности и уколом в столбик.
Этап.
А. Учет роста на среде накопления, оценка чистоты культуры в мазке по Граму.Отмечают характер роста выделенной чистой культуры. Визуально чистая культура характеризуется однородным ростом. При микроскопическом исследовании окрашенного мазка, приготовленного из такой культуры, в нём в разных полях зрения обнаруживаются морфологически и тинкториально однородные клетки. Однако в случае выраженного плеоморфизма, присущего некоторым видам бактерий, в мазках из чистой культуры могут встречаться одновременно клетки с различной морфологией.
Если в качестве среды накопления использовали индикаторную среду Клиглера, то оценивают изменения ее цвета в столбике и скошенной части, по которым определяют биохимические свойства: ферментацию глюкозы, лактозы и продукцию сероводорода. При разложении лактозы желтеет скошенная часть среды, при разложении глюкозы – желтеет столбик. При образовании CO 2 в процессе разложения сахаров образуются газовые пузырьки или разрыв столбика. В случае продукции сероводорода отмечается почернение по ходу укола из-за превращении сульфата железа в сульфид железа.
Характер изменения цвета среды Клиглера (рис. 23) объясняется неодинаковой интенсивностью расщепления микроорганизмами азотистых веществ и образования щелочных продуктов в аэробных (на скошенной поверхности) и анаэробных (в столбике) условиях.
В аэробных условиях на скошенной поверхности происходит более интенсивное щелочеобразование, чем в столбике среды. Поэтому при разложении глюкозы, присутствующей в среде в небольшом количестве, образующаяся на скошенной поверхности кислота быстро нейтрализуется. В то же время при разложении лактозы, присутствующей в среде в высокой концентрации, щелочные продукты не способны нейтрализовать кислоту.
В анаэробных условиях в столбике щелочные продукты образуются в ничтожном количестве, поэтому здесь выявляется ферментация глюкозы.
Рис. 23. Индикаторная среда Клиглера:
1 – исходная,
2 – с ростом E. coli,
3– с ростом S. paratyphi B,
4 –с ростом S. typhi
E. coli разлагают глюкозу и лактозу с газообразованием, не продуцируют сероводород. Они вызывают пожелтение столбика и скошенной части с разрывами среды.
S. paratyphi разлагают глюкозу с газообразованием, лактозоотрицательны. Они вызывают пожелтение столбика с разрывами, скошенная часть не изменяет цвет и остается малиновой. При этом S. paratyphi B продуцируют сероводород (по ходу укола появляется черная окраска), S. paratyphi A сероводород не продуцируют.
S. typhi разлагают глюкозу без газообразования, лактозоотрицательны, продуцируют сероводород. Они вызывают пожелтение столбика без разрывов, скошенная часть не изменяет цвет и остается малиновой, по ходу укола появляется черная окраска.
Shigella spp. глюкозопозитивны, лактозоотрицательны, не продуцируют сероводород. Они вызывают пожелтение столбика (с разрывами или без них в зависимости от серовара), скошенная часть не изменяет цвет и остается малиновой.
Б. Окончательная идентификация чистой культуры (определение систематического положения выделенного микроорганизма до уровня вида или варианта) и определение спектра чувствительности выделенной культуры к антибиотикам.
Для идентификации чистой культуры на этом этапе изучают биохимические, генетические, серологические и биологические признаки (табл. 8).
В рутинной лабораторной практике при идентификации нет необходимости изучать все свойства. Используютинформативные, доступные, простые тесты, достаточные для определения видовой (вариантной) принадлежности выделенного микроорганизма.
