Bakterioloģisko pētījumu veidi. Vadlīnijas. Oportūnistisko mikroorganismu bakterioloģiskās izpētes metodes klīniskajā mikrobioloģijā
APSTIPRINĀTA RSFSR Veselības ministrija 1991. gada 19. decembrī
Vadlīnijas sastādījis A.N.Kaļuks.
Oportūnistisku patogēnu bakterioloģiskie pētījumi
Visaptverošs laboratoriskais mikrofloras pētījums ietver materiāla bakterioskopiskus un bakterioloģiskus pētījumus, kas veikti dinamikā pēc uzņemšanas stacionārā, ārstēšanas laikā, kā arī pēc indikācijām pacientiem, kuri tiek ārstēti ambulatori. Diagnostikas materiālu ieteicams inokulēt uz blīvām barotnēm, kas izslēdz viena mikroorganisma augšanas nomākšanu ar citu mikroorganismu un ļauj kvantitatīvi novērtēt izaugušo koloniju skaitu. Mikroorganismu augšanas intensitāti var izteikt krustojumos un atbilst noteikta skaita mikrobu šūnu saturam 1 ml diagnostikas materiāla:
++++ Saplūstošu koloniju bagātīga augšana (10 m/cl)
+++ Izolētu koloniju masveida pieaugums (10 m/šūnā)
++ mērena daudzu saskaitāmu koloniju augšana (vismaz 50) (10-10 m/kl)
+ vāja atsevišķu koloniju augšana (30-50) (10 m/šūnā).
Ar dozētu sējumu nosaka absolūto mikroorganismu saturu 1 ml vai 1 g pārbaudāmā materiāla. Etioloģiski nozīmīgais baktēriju saturs 1 ml (1 g) materiāla ir 10 un vairāk. Noteikta veida mikroorganismu kvantitatīvais pārsvars ir viens no rādītājiem, kas liecina par tā līdzdalību pioiekaisuma procesā. Bakterioloģiskās izmeklēšanas rezultātu galīgā interpretācija tiek veikta pēc anamnētisko datu, klīnisko simptomu un antibiotiku terapijas rezultātu izpētes. Nosūtot materiālu sējai, jāievēro noteikti noteikumi. Materiāls jāpārbauda pirms antibiotiku terapijas uzsākšanas vai pēc tāda perioda pēc antibakteriālo līdzekļu ievadīšanas, kas nepieciešams to izvadīšanai no pacienta organisma (2-3 dienas krēpu testiem, 4-7 dienas urīnam). Antibiotiku lietošana samazina mikroorganismu izolēšanas biežumu 3-4 reizes. Diagnostikas materiāla ražas tiek veiktas dinamikā (3-5 reizes), kas precizē slimības etioloģiju, ļauj izsekot patogēna noturības ilgumam, kontrolēt terapijas efektivitāti. Intervāls starp materiāla savākšanu un sēšanu nedrīkst pārsniegt 1-2 stundas.
Augšdaļas mikrofloras izpēte elpceļi(rīkle, deguns, mute). Pētījuma materiāls ir: gļotas, strutaini izdalījumi, garozas, plēve, infiltrātu gabali biopsijas laikā. Materiāls mikrobioloģiskajiem pētījumiem no mutes dobumsņem tukšā dūšā ar sterilu vates tamponu no gļotādas pie siekalu dziedzeru kanālu izejas, mēles virsmas, no čūlām (skrāpējot ar karoti), no visvairāk skartajām vietām. Ja ir plēve, pēdējo noņem ar pinceti. Materiālu no deguna dobuma ņem ar sausu sterilu vates tamponu. Materiāls iesēts uz Petri trauciņiem ar asinīm, dzeltenuma-sāls agariem, Saburo barotni. Sējot ar tamponu, materiāls tiek ierīvēts barotnē no visas tampona virsmas nelielā 1-2 cm laukumā un pēc tam ar vēzieniem pa visu virsmu. Vienlaikus ar sēšanu tiek sagatavotas uztriepes un iekrāsotas pēc grama.
Apakšējo elpceļu mikrofloras izpēte. Pētījuma galvenais materiāls ir krēpas, kas tiek savāktas pētījuma dienā, no rīta, pēc zobu tīrīšanas un mutes skalošanas ar svaigi vārītu ūdeni. Plkst bagātīga izdalīšanās krēpas, pirmās porcijas jāatklepo iesmā, bet nākamās savāc sterilos trauciņos un nogādā laboratorijā. Krēpu mikrofloras pētīšanai tiek izmantota gan neatšķaidītu krēpu sēšana (kvalitatīvā metode), gan atšķaidīšanas metode, ko sauc par kvantitatīvo. Ar kvalitatīvu sēšanas metodi izmanto strutojošus krēpu gabaliņus, kas izskaloti fizioloģiskā šķīdumā no mutes dobuma mikrofloras. Ar kvantitatīvām metodēm homogenizē 1 ml krēpu. Pēc tam tiek veikti atšķaidījumi, lai samazinātu perorālo mikroorganismu skaitu tajā. Ar abām metodēm vienlaikus ar kultūru sagatavo uztriepi, ko iekrāso ar Gramu. Tiek pētītas strutainas un mukopurulentas krēpas, kurās ir leikocīti un alveolārā epitēlija šūnas, mucīnā mijas šūnas, kuru klātbūtne ir raksturīga apakšējo elpceļu izvadīšanai. Pievērsiet uzmanību mikroflorai, kas dominē vietējo krēpu uztriepes, īpaši kapsulāro diplokoku (pneimokoku), mazo gramnegatīvo nūjiņu (Pfeifera stienis) utt.
kvalitātes metode. Laboratorijā krēpas ielej Petri trauciņā, atlasa 2-3 strutojošus kunkuļus, kurus vienu reizi mazgā fizioloģiskā šķīdumā un pēc tam inokulē uz asiņu un dzeltenuma-sāls agara, Endo un Saburo barotnēm. Sēšana tiek veikta ar sterilu stikla lāpstiņu, vienmērīgi berzējot materiālu uz barības barotnes virsmas. Uzreiz pēc inokulācijas uz asins agara plāksnes tiek novietoti diski ar antibiotikām (streptomicīns, penicilīns, tetraciklīns, eritromicīns un levomicetīns), kas ļauj iegūt skaidru informāciju par inokulācijā dominējošās mikrofloras jutību pret zālēm. Otrajā dienā tiek ņemts vērā izaugušo koloniju skaits (vairāk nekā 50 koloniju pieaugums tiek uzskatīts par etioloģiski nozīmīgu), populācijas vienveidība un zāļu jutība to augšanas laikā monokultūrā.
kvantitatīvā metode. No laboratorijā nogādātajām krēpām ņem 1 ml, pievieno 9 ml gaļas-peptona buljona un 20 minūtes homogenizē burciņā ar pērlītēm. No iegūtās emulsijas sagatavo desmitkārtīgus sērijas atšķaidījumus. Sēšana tiek veikta apgrieztā secībā no mazāka atšķaidījuma. Inokulēt 0,1 ml atšķaidītu krēpu 10 un 10 uz katru asins agara plāksni. Sējot uz dzeltenuma-sāls agara, Endo un Sabouraud barotnes gatavo no sākotnējās atšķaidīšanas 1:10. Kultūraugus inkubē vienu dienu 37°C temperatūrā. Otrajā dienā tiek apskatīti krūzes un ņemts vērā katra mikroorganismu veida skaits miljonos. Baktēriju saturs 10 m/cl un vairāk 1 ml krēpu tiek atzīts par diagnostiski nozīmīgu.
Bronhu skalošanas, skalošanas šķidruma sēšana. No pārbaudāmā materiāla ņem gļotu gabaliņus, kurus bez iepriekšējas mazgāšanas fizioloģiskā šķīdumā inokulē uz cietas barotnes (sk. krēpu kultūru) un mēģenē ar cukura buljonu. Ja nav gļotu gabaliņu, Pastēra pipetē savāktais materiāls tiek inokulēts. Inkubācija dienas laikā 37°C temperatūrā.
Acu mikrofloras izpēte. Paraugus pētījumiem ārsts ņem ar sterilu vates tamponu vai stikla stienīti. Materiālu ņem no skartajām vietām un sēj 0,5% cukura buljonā. Ja augšanas nav, pēc 48 stundām tiek sniegta negatīva atbilde.
Iztriepju pārbaude no auss. Materiālu ņem ar sterilu vates tamponu no dzirdes kanāla un uzsēj uz asiņu un dzeltenuma-sāls agara, Sabouraud barotnes, ierīvējot materiālu barotnes laukumu, pēc tam to paberzē pa visu trauku.
Urīna pētījums. Pētījumā tiek ņemta vērā vidējā rīta urīna daļa, kas iegūta normālas urinēšanas laikā vai ņemta ar katetru. Bakteriūrijas indikators, kam klīniskā nozīme, tiek ņemts vērā 100 000 vai vairāk mikrobu klātbūtne 1 ml urīna.
Pirmā pētījuma diena. Viena standarta (3 mm) bakterioloģiskā urīna cilpa (rūpīgi sajaukta) tiek iesēta A, I, II un III sektoros Petri trauciņā ar 5% asiņu vai vienkāršu agaru. Tajā pašā laikā sektora A barotnes zonā tiek veikta sēšana, vienmērīgi noberžot materiālu pa visu virsmu, pēc tam, neņemot jaunu materiālu, tiek veikta tā pati cilpa ar sitieniem pa barības vielu barotnē. I sektors (3-4 sitieni), no I sektora uz II, no II sektora - III.
1. tabula
Baktēriju koloniju skaits dažādos Petri šķīvja sektoros atkarībā no bakteriūrijas pakāpes (saskaņā ar V.S. Rabinovski un V.V. Rodomanu)
|
Baktēriju skaits 1 ml urīna |
Koloniju skaits dažādos Petri šķīvja sektoros |
|||
|
Mazāk par 1 tūkst |
nav izaugsmes |
nav izaugsmes |
||
|
ļoti liels |
||||
|
no vienības līdz 25 |
||||
Otrā pētījuma diena. Bakteriūrijas pakāpi nosaka saskaņā ar 1. tabulu atkarībā no sektora, kurā konstatēta mikroorganismu koloniju augšana. Ja 1 ml urīna ir mazāk nekā 100 tūkstoši mikrobu, koloniju augšana tiek novērota tikai Petri trauciņa A sektorā. Par ko vairāk liecina koloniju pieauguma parādīšanās I sektorā augsta pakāpe bakteriūrija. Saskaitīt kolonijas nozarē ar vismazāko izaugsmi nav grūti. Sektoru kultūru metode vairumā gadījumu ļauj izolēt slimības izraisītāju tīrkultūrā jau otrajā pētījuma dienā.
Brūču, punktētu, eksudātu, rezektu audu mikrofloras izpēte. Eksudātus un punktus ar Pastēra pipeti inokulē mēģenēs ar asinīm un vienkāršu gaļas-peptona agaru, cukura buljonu. Uztriepes ar diagnostisko materiālu iesēj uz Petri trauciņiem ar 5% asiņu un 10% dzeltenuma-sāls agariem. Materiālu berzē gar barotnes malu un pēc tam izklāj pa trauku, izmantojot to pašu tamponu vai bakterioloģisko cilpu.
Sieviešu dzimumorgānu mikrofloras izpēte. Izdalījumi tiek savākti ar sterilu vates tamponu un inokulēti uz Petri trauciņiem ar 5% asins agaru, dzeltenuma-sāls agaru un mēģenē ar cukura buljonu, kā arī uz Endo barotnes.
Žults pētījums. Žulti savāc zondēšanas vai operācijas laikā sterilās mēģenēs un nogādā laboratorijā ne vēlāk kā 2 stundu laikā no parauga ņemšanas brīža. 0,1 ml žults izklāj uz asins agara plāksnes un Endo barotnes. Kultūraugus un atlikušo izejmateriālu ievieto termostatā 37°C temperatūrā. Pēc 24 stundām primāro inokulāciju rezultātus ņem vērā, saskaitot katras sugas koloniju skaitu uz blīvām barotnēm.
Asins pētījums. Pēc rūpīgas ādas apstrādes (spirts, ēteris) pie pacienta gultas tiek iesētas asinis. No kubitālās vēnas ņem 10 ml asiņu, kuras ielej divās kolbās: pirmajā ar 150-200 ml cukura buljona un otrajā ar tioglikola barotni (katra 5 ml). Kultūras tiek turētas termostatā 10 dienas. 2., 3., 5. un 10. dienā uz Petri trauciņiem veic kontroles sēklas ar 5% asins agaru. 5 ml asiņu var iesēt flakonā ar barotni divās fāzēs: cietā un šķidrā (5% asiņu agara slīpums ar 1% glikozes un 50 ml 0,5% cukura buljona). Šis paņēmiens novērš nepieciešamību pēc atkārtotas sēšanas, novērš iespēju ražu piesārņot ar apkārtējās vides mikrofloru un ļauj ņemt vērā izaugušo koloniju skaitu (t.i., novērtēt bakterēmijas intensitāti). Sēju ievieto termostatā 37°C uz 10 dienām. Katru dienu flakonu saturs tiek sakrata un blīvās uzturvielu barotnes slīpuma virsma tiek mitrināta, noliecot flakonu. Kad kolonijas aug uz asins agara slīpuma, no tām sagatavo uztriepes un tālāk identificē saskaņā ar bakterioloģijā vispārpieņemtiem noteikumiem. Ja 10. dienā nav mikroorganismu augšanas, tiek sniegta galīgā atbilde - asins kultūra ir sterila.
Pētījumi par zarnu disbiozi. Patvaļīgu fekāliju daudzumu ņem uz iepriekš sagatavotiem un nosvērtiem (subpergamenta vai vaska papīra) 3x2 steriliem papīriem un nosver uz vērpes svariem. Papīrs kopā ar materiālu tiek ievietots sterilā mēģenē. Izkārnījumu parauga svaru, atskaitot papīra svaru, reizina ar 9. Pēc pavairošanas iegūtā summa ir vienāda ar fizioloģiskā šķīduma daudzumu, kas jāpievieno mēģenē. Atšķaidījums 1:10 (I).
Piemēram: papīra lapas svars ir 20 mg
fekāliju svars ar papīra gabalu 420 mg
420-20=400 mg; 400 mg9=3600 (3,5 ml).
Pēc emulgācijas ar stikla stienīti vai sterilu pipeti suspensijām ļauj nostāvēties istabas temperatūrā 10-15 minūtes un 0,1 ml pārnes uz nākamo mēģeni ar 9,9 ml fizioloģiskā šķīduma (atšķaidījums 10). Pēc tam izkārnījumus atšķaida līdz titram 10. No galvenā atšķaidījuma (10) inokulāciju veic uz cietām barotnēm, lai izolētu zarnu dzimtas patogēnos mikrobus (Ploskirev, Levin barotne). Tajā pašā laikā tiek veikta masīva (0,5-1,0) inokulācija uz šķidrās bagātināšanas barotnēm (Muller, selenīts, magnijs). No mēģenes, kurā fekālijas atšķaida līdz 10, Sabouraud un JSA barotnes virsmai pievieno 0,1 ml. No atšķaidījuma 10 inokulācijas veic uz plāksnēm ar 0,5% asins agaru un Endo barotni, katra pa 0,1 ml. Lai iegūtu izolētu koloniju augšanu, izmanto stikla lodītes vai lāpstiņas. Stikla apaļas krelles 12-14 gabali (iepriekš sterilizētas) tiek nolaistas krūzē ar sēklām. Viegli šūpojot krūzīti ar pērlītēm 1 minūti, materiāls tiek vienmērīgi sadalīts pa barības vidi. Sēšana ar pērlītēm sākas no barotnes, uz kuras tika iesēts lielākais atšķaidījums (10), pērlītes pārnesot uz mazāku atšķaidījumu. Lai izolētu anaerobās bifidobaktērijas, inokulēt no 10, 10 un 10 atšķaidījumiem 2 mēģenēs (katra 0,1 un 1 ml) ar Blauroka barotni, kas reģenerēta 1 stundu. Pēc inokulācijas tūbiņas enerģiski griež starp plaukstām, lai vienmērīgi sadalītu suspensiju. Aerobu audzēšanas vidi ievieto termostatā 37°C (Sabouraud - pie 20°) uz 18-24 stundām. Anaerobu augšanu uz Blauroka barotnes ņem vērā pēc 48-72 stundām Nākamajā dienā pēc sēšanas Escherichia coli un citu mikrobu skaitu 1 g izkārnījumos nosaka koloniju skaits, kas izaugušas uz atbilstošās barības vielas. barotne, pārrēķināta pēc inokulētā materiāla daudzuma un tā atšķaidījuma pakāpes. Tātad, ja Endo barotnē izauga 30 laktozes negatīvas kolonijas, kad tika inokulēts 0,1 ml fekāliju no atšķaidījuma 10 (1: 100 000), aprēķins jāreizina ar 30 ar 10 un ar 100 000, t.i. 1 g būs 30 000 000 laktozes negatīvo enterobaktēriju. Tiek ņemts vērā laktozes negatīvo un hemolītisko Escherichia coli koloniju skaits, stafilokoku, Proteus un citu mikroorganismu klātbūtne. Tiek noteiktas mikroorganismu fermentatīvās īpašības un zāļu jutība. Uztriepes sagatavo no mēģenēm ar Blauroka barotni. Zem mikroskopa bifidobaktērijām ir raksturīgu grampozitīvu stieņu izskats, kas ir sabiezināti vai sazaroti galos, sakārtoti romiešu cipara V formā, bieži vien kopu veidā. Bakteriologa atbilde norāda katras mikroorganismu grupas procentuālo vai absolūto skaitu.
Mikroorganismu identificēšana. Mikroorganismu noteikšanas metodes balstās uz kultūru morfoloģisko, kultūras, bioķīmisko, antigēno un citu īpašību izpēti.
Morfoloģiskās īpašības tiek pētītas, veicot diagnostikas materiāla bakterioskopiju un uztriepes no kolonijām, kas audzētas uz blīvām un šķidrām barotnēm. Stikla priekšmetstikliņu uztriepes tiek fiksētas uz degļa liesmas vai šķidros fiksatoros (96 °, spirtā, Ņikiforova maisījumā), kas iekrāsoti atbilstoši gramam. Apskatot uztriepes no krēpām, tiek novērtēta visa pieejamā mikroflora: grampozitīvu koku (stafilokoku, mikrokoku) kopu klātbūtne, grampozitīvu koku ķēdes (streptokoki), mazi lanceolāti diplokoki, ko ieskauj nekrāsotas kapsulas (pneimokoku) zona. , gramnegatīvie koki (neisseria); Gramnegatīvās nūjiņas (zarnu, Pseudomonas aeruginosa, Proteus); Gramnegatīvi stieņi ar noapaļotiem galiem, ko ieskauj kapsula gaiša oreola formā (Klebsiella), mazi gramnegatīvi nūjiņas kopu veidā (hemofīlās baktērijas) utt. Bakterioskopiskā izmeklēšana ir indikatīva. Turpmākie pētījumi ietver materiāla inokulāciju uz barības vielu barotnēm, tīrkultūru izolēšanu, to identificēšanu un zāļu jutības noteikšanu. Kultūras īpašības tiek pētītas, aplūkojot audzētas kultūras uz cietām un šķidrām barotnēm. Uz blīvām barotnēm tiek ņemts vērā koloniju lielums, krāsa, caurspīdīgums, forma, pigmenta klātbūtne, hemolīze ap koloniju un tās raksturs utt. Uz šķidrām barotnēm tiek atzīmēta to caurspīdīgums, nogulsnes (augšana apakšā) vai plēve uz barotnes virsmas. Bioķīmisko īpašību izpēte balstās uz fermentatīvās saharolītiskās aktivitātes noteikšanu, spēju izmantot barības vielas aerobos un anaerobos kultivēšanas apstākļos. Kultūru antigēnās īpašības tiek pētītas, baktēriju un to antigēnu mijiedarbībā ar atbilstošiem antiserumiem (aglutinācijas reakcijas, imunofluorescence u.c.). Pēc morfoloģisko un kultūras īpašību izpētes tiek veikti diferenciālie testi ar mikroorganismu tīrkultūrām.
Grampozitīvi koki. Grampozitīvie koki pieder pie Micrococcaceae dzimtas, kurā ietilpst Micrococcus un Staphylococcus ģints un Streptococcaceae dzimta.
Micrococcaceae dzimta. Medicīnas mikrobioloģijai ir nepieciešams atšķirt stafilokokus no mikrokokiem. Viņi pēta morfoloģiskās īpašības, hemolīzi, spēju augt uz barotnes ar sāli, pigmenta veidošanos, glikozes fermentāciju līdz skābei anaerobos apstākļos, glicerīna fermentāciju. Mikrokokiem ir 2–3 reizes lielāks šūnu izmērs (0,5–3,5 µm), anaerobos apstākļos neraudzē glikozi un glicerīnu, un tiem ir dzeltens līdz rozā pigments. Dažādu veidu stafilokoku diferenciācija tiek veikta saskaņā ar testu kopumu: plazmas koagulācijas spēja, lecitināzes aktivitāte, mannīta fermentācija anaerobos apstākļos, pigmenta veidošanās, jutība pret novobiocīnu (tests ir pozitīvs uz St. aureus un St. epidermidis un negatīvs attiecībā uz St. saprophyticus). Lai izolētu stafilokoku, testa materiālu inokulē uz diferenciāldiagnostikas barotnes: dzeltenuma-sāls agara. Krāsojot ar gramu, stafilokoks ir grampozitīvs un atrodas atsevišķi, pa pāriem vai veido kopas neregulāru kaudžu veidā. Staphylococcus ir izturīgs pret paaugstinātu koncentrāciju nātrija hlorīdā (7-10%), ko izmanto, lai to izolētu no patoloģiskā materiāla. Audzējot uz gaļas-peptona buljona, tas rada vienmērīgu duļķainību un rada flokulējošas nogulsnes. Uz blīvām barotnēm stafilokoki aug apaļu, spīdīgu koloniju veidā ar gludām malām (0,5-1,5 mm diametrā). Otrajā pētījuma dienā tiek novērtēta audzēto koloniju kvantitatīvā augšana, ņemta vērā lecitināzes aktivitāte un izolēta mikroba tīrkultūra (pārstādīta mēģenēs ar pienu vai vienkāršu slīpo agaru). Trešajā dienā - viņi veic diferenciācijas un zāļu jutības testus.
Nosakot koagulāzes aktivitāti, izmanto liofilizētu trušu asins plazmu, kas atšķaidīta ar sterilu fizioloģisko šķīdumu 1:5 un ielej sterilās mēģenēs pa 0,5 ml katrā. Testējamā celma ikdienas agara kultūras 1 cilpa tiek inokulēta mēģenē un ievietota termostatā 37 °C temperatūrā. Rezultāti tiek reģistrēti pēc 30 minūtēm, 1 stundas, 2 stundām un 24 stundām. Visas plazmas koagulācijas pakāpes no neliela tromba, kas paliek nekustīgs, kad caurule tiek apgriezta otrādi, tiek uzskatīta par pozitīvu.
Lecitināzes aktivitāti nosaka uz dzeltenuma-sāls agara. Reakciju reģistrē pēc 24-48 stundām makroskopiski ar duļķainas zonas un zaigojoša vainaga klātbūtni ap stafilokoku kolonijām, kas norāda uz lecitināzes enzīma klātbūtni tajās.
Pētot mannīta fermentāciju, testa celma ikdienas agara kultūras inokulāciju veic ar stūri 1% agara kolonnā ar mannītu un vazelīna eļļu. Mannīta fermentācijas laikā agara kolonna kļūst zila. Par pozitīvu reakciju uzskata, fermentējot 2/3 agara kolonnas.
Lai noteiktu pigmenta veidošanos stafilokoku kultūrām, tās inokulē uz 10% piena agara. Grāmatvedība 18-20 stundu laikā.
Stafilokoku kultūras hemolītisko spēju noteikšanu veic uz 5% asins agara (donora asinīm bez antiseptisku līdzekļu pievienošanas), izmantojot apgaismojumu ap audzētajām kolonijām, kuras ir skaidri nosakāmas caurlaidīgā gaismā. Pozitīvs hemolītiskais tests uz cilvēka asins agara parasti ir saistīts ar hemotoksīniem, savukārt stafilokoku infekciju patoģenēzē galvenā loma ir alfa toksīnam, ko var noteikt uz truša asins agara.
Streptococcaceae dzimta. Streptokoki ir liela un diezgan neviendabīga mikroorganismu grupa. Visvairāk pētīti aerobikas pārstāvji: Streptococcus pyogenes, S. faecalis, S. pneumoniae. Mikrobam ir sfēriska forma, grampozitīvs, uztriepes no blīvām barotnēm tas atrodas īsu 2-3 koku ķēžu veidā, uz šķidrām barotnēm tas dod garākas ķēdes. Audzējot streptokokus, jāņem vērā to palielinātā nepieciešamība pēc barības vielas Ak. Tāpēc streptokoku audzēšanai izmanto uzturvielu barotnes, kas satur glikozi (1%), asinis (5-10%), serumu (10-20%).
AKTIVITĀTE #4
TEMATS: MIKROORGANISMU FIZIOLOĢIJA. BAKTERIOLOĢISKĀS (KULTŪRAS) IZPĒTES METODE. MIKROORGANISMU BIOKĪMISKĀS ĪPAŠĪBAS.
PĀRBAUDES SARAKSTS
Baktēriju uzturs. Uzturvielas ir oglekļa un slāpekļa avoti. Baktēriju klasifikācija pēc uztura veidiem Autotrofi un ķīmijorganotrofi
Izaugsmes faktori un to avoti. Minerālu elementu avoti.
Barības vielu pārnešanas caur membrānu veidi un mehānismi.
Baktēriju enerģijas prasības. Enerģijas iegūšanas veidi autotrofos (fotosintēze, ķīmiskā sintēze). Enerģijas avoti un iegūšanas veidi ķīmijorganotrofos.
Aerobie un anaerobie bioloģiskās oksidācijas veidi baktērijās. Aerobās, anaerobās, fakultatīvās anaerobās un mikroaerofīlās baktērijas. Veidi, kā radīt anaerobos apstākļus.
Bakterioloģiskās (kultūras) pētījumu metodes uzdevumi, posmi, priekšrocības un trūkumi.
Mikroorganismu augšana un vairošanās. Reprodukcijas metodes. Binārā (vienkāršā) skaldīšana, mehānisms. Baktēriju populāciju pavairošana.
Baktēriju audzēšanas principi un metodes. Mikrobu uztura vajadzības.
Barības barotnes baktēriju audzēšanai. uzturvielu prasības. Barības vielu barotņu klasifikācija.
Baktēriju kultivēšanas nosacījumi un paņēmieni. Sēšanas tehnika uz uzturvielu barotnēm. Baktēriju augšanas likumsakarības un raksturs uz blīvām un šķidrām barotnēm.
Aerobo un anaerobo baktēriju tīrkultūru izolēšanas metodes.
Izolētu kultūru identificēšanai izmantotās īpašības.
PATSTĀVĪGS UN LABORATORIJAS DARBS
Bakterioloģiskā metode(posmi):
1 1. posms aerobo baktēriju tīrkultūras izolēšana: A) Patoloģiskā materiāla mikroskopija.
Patoloģiskā materiāla uztriepes gramu iekrāsošana. Narkotiku skice.
B) Patoloģiskā materiāla sēšanas tehnikas apguve skolotāja vadībā ar bakterioloģisko cilpu un lāpstiņu uz šķīvja barotnes.Patoloģiskā materiāla inokulācija ar bakterioloģisko cilpu uz lamelārā gaļas-peptona agara (MPA), lai iegūtu izolētas kolonijas.
Barotnes klasifikācija(norādiet pielietojuma jomas)
1. Pēc konsekvences:šķidrums (gaļas-peptona buljona, žults, cukura buljona), blīva (2-3% agara) un pusšķidra (0,15-0,7% agara) barotne.
2. Pēc izcelsmes:dabīgs - no piena, gaļas. olas, kartupeļi, cilvēka asins serums, dzīvnieku un citi produkti; mākslīgs — 1) dabiski sabalansēti barības vielu maisījumi koncentrācijās un kombinācijās, kas nepieciešamas mikroorganismu augšanai un pavairošanai, universāls slāpekļa un oglekļa avots - peptoni - proteīnu nepilnīgas sadalīšanās produkti, izmantojot pepsīnu vai dažādus hidrolizātus (zivis, kazeīns, raugs utt.) . 2) sintētisks cprecīzi ķīmiskais sastāvs Soton – mikobaktērijām, 199 – šūnām.
3. Sastāvā: vienkārši kultūras mediji (gaļas-peptona buljons-MPB, gaļas-peptona agars-MPA) un ar nepatiess (KA = MPA + 5-10% dzīvnieku asiņu)
4. Pēc pieraksta:
BET) vispārīgs mērķis - universāls, paredzēts jebkuru mikroorganismu audzēšanai (MPA, KA)
B ) Īpašitādu mikroorganismu audzēšanai, kuri neaug uz universālajām barotnēm, sugu diferenciācijai un atsevišķu mikroorganismu veidu selektīvai izolēšanai:
izvēles (izvēles) izolēt noteikta veida mikroorganismus un nomākt radniecīgo augšanu - (sāls agars stafilokokiem).
diferenciāldiagnostika (DDS)-vide, kas ļauj atšķirt baktēriju veidus pēc fermentatīvās aktivitātes; Viņi ar piemīt: 1) universāla barotne (MPA, KA); 2) diferencējošais faktors - ķīmiskais substrāts (piemēram, ogļhidrāts), kura atšķirīga saistība ir diagnostikas pazīme konkrētam mikrobam 3) Indikators, kura krāsas maiņa norāda uz bioķīmisku reakciju. (Endo, Ploskirev, Giss un citas vide).
diferenciāli selektīvs (DS) - vide, kas ļauj piešķirt noteiktas sugas baktērijas pēc to fizioloģiskajām īpašībām un atšķiras no citām sugām pēc fermentatīvā aktivitāte Tie satur: 1) MPA 2) izvēles ķīmiskais substrāts, kas kavē cita veida baktēriju augšanu . 3) diferencējošais faktors - substrāts, kuram ir šī mikroba diagnostikas pazīme;) 4.) Indikators, kura krāsas maiņa norāda uz bioķīmisko reakciju. (trešdienās pret stafilokokiem, ICA pret salmonellu, Ploskirev pret šigelām un salmonellām).
B) Bagātināšana barotne noteikta veida baktēriju reprodukcijai un uzkrāšanai klīniskajā materiālā (asinis 20% žults buljonā = salmonella, rīkles izdalījumi 10% serumā + 2% telurīts = korinebaktērijas).
D) Transports vide klīniskā materiāla savākšanai un piegādei (saglabāšanai) = 48 stundas (Amies medium - pusšķidrs agars + aktīvā ogle).)
Uzturvielu barotnes(piemēri):
Trešdiena Endo Vidēja tipa enterobaktēriju diferenciāldiagnostika Uzturvielu bāze MPA diferencējošais faktors laktoze 1% Indikators bāziskais fuksīns, kas atkrāsots ar nātrija sulfītu. E.s oli sadala laktozi līdz skābei - kolonijas ir sarkanas ar metālisku spīdumu, patogēnas bezkrāsainas;
Sāls agars Vidēja tipa selektīvs stafilokoku izolēšanai Uzturvielu bāze MPA izvēles faktors nātrija hlorīds 10%
Trešdiena Ploskirev Vidēja tipa diferenciāli selektīvsenterobaktērijām
Uzturvielu bāze MPA izvēles faktors žults sāļi diferencējošais faktors laktoze
Indikators neitrāls sarkans
Dzeltenuma-sāls agars Vidēja tipa diferenciāls selektīvs priekš S . aureus _
Uzturvielu bāze MPA izvēles faktors nātrija hlorīds 10%
diferencējošais faktors olas dzeltenums
Indikators Nē
2 2. posms bakterioloģiskās izpētes metode (tīrkultūras izdalīšana):
A) Izolētu koloniju (escherichia, staphylococcus) izpēte uz lamelārās MPA.
|
Pētīja kultūras objektus |
1 koloniju veids |
2 veidu kolonijas |
|
kolonijas forma |
Regulāras formas, apaļas |
Pareiza forma |
|
Konsekvence |
viendabīgs |
viendabīgs |
|
Kolonijas lielums |
vidējs (izmērs 2-4 mm) | |
|
Malas raksturs |
ar gludām malām |
ar gludām malām |
|
Virsmas daba |
izliekts |
B) Uztriepes sagatavošana no izvēlētām kolonijām (Grama traips).
C) Izolētu koloniju pārvietošana uz slīpu MPA tīrkultūras uzkrāšanai.
3 Anaerobo baktēriju tīrkultūras izolēšana: augsnes suspensijas inokulācija uz Kitta-Tarozzi barotnes, lai izolētu patogēnās klostrīdijas.
Kitt-Tarozzi barotne sastāv no uzturvielu buljona, 0,5% glikozes un aknu vai maltas gaļas gabaliņiem, lai absorbētu skābekli no barotnes. Pirms sēšanas barotni 20-30 minūtes karsē verdoša ūdens vannā, lai no barotnes izvadītu gaisu. Pēc sēšanas barības barotni nekavējoties piepilda ar slāni parafīns
Anaerobiozes veidošanas metodes:
1.fiziskais- izsūknējot gaisu, ieviešot īpašu bezskābekļa gāzes maisījumu (parasti N 2 - 85% CO 2 - 10%, H 2 - 5%), barotnes iepriekšēja vārīšana, inokulācija dziļā agara kolonnā, barotnes piepildīšana ar vazelīna eļļu, lai samazinātu skābekļa piekļuvi, hermētiski noslēgtu flakonu un mēģeņu, šļirču un laboratorijas stikla trauku izmantošana ar inertu gāzi, cieši noslēgtu eksikatoru izmantošana ar degošu sveci
2. Ķīmiskā - tiek izmantoti ķīmiskie skābekļa savācēji.
3. Bioloģiskā - stingru aerobu un anaerobu kopīga audzēšana (aerobi absorbē skābekli un rada apstākļus anaerobu pavairošanai - Fortnera metode).
Trešdiena Kits - Tarozzi sastāv no uzturvielu buljona, 0,5% glikozes un aknu vai maltas gaļas gabaliņiem, lai absorbētu skābekli no apkārtējās vides. Pirms sēšanas barotni 20-30 minūtes karsē verdoša ūdens vannā, lai no barotnes izvadītu gaisu. Pēc sēšanas barības barotni nekavējoties piepilda ar slāniparafīns vai vazelīna eļļu, lai izolētu no skābekļa piekļuves.
4. Jaukti - izmantot vairākas dažādas pieejas.
Anaerobo apstākļu radīšanai tiek izmantotas īpašas ierīces - anaerostati. Šobrīd vienkāršākā un efektīvākā iekārta anaerobo un mikroaerofilo apstākļu radīšanai ir ķīmiska metode ar speciāliem maisiem, kas darbojas pēc atmosfēras skābekļa absorbcijas principa hermētiski noslēgtos traukos .
Vilsona-Blēra medijs (caurules, krūzes):
Uzturvielu bāze MPA Elpošanas substrāts glikoze
Samazinošs faktors nātrija sulfīts un dzelzs hlorīds nātrija sulfītsNa 2 SO 3 → Na 2 S
Vilsona-Blēra videi bāze ir agars ar papildinājumu glikoze , Klostridijas formā šajā datu nesējā kolonijas melna krāsa restaurācijas dēļ sulfīts pirms tam sulfīds - anjons , kas ir saistīts ar katjoni dziedzeris (II) dod melno sāli. Parasti šajā izglītības vidē melnā krāsā kolonijas , parādās agara kolonnas dziļumā .
Tioglikola barotne (vide sterilitātes kontrolei): (caurules):
Uzturvielu bāze BCH Elpošanas substrāts glikoze Samazinošs faktors nātrija tioglikolāts
Indikators resazurīns
Zeissler glikozes agars asinīs: (glāzes): Uzturvielu bāze MPA, asinis
Elpošanas substrāts glikoze Samazinošs hemoglobīna faktors
Tika ieviests termins "anaerobi".Luiss Pastērskurš atklāja 1861. gadābaktērijassviesta fermentācija.
BET3. lekcija Mikroorganismu fizioloģija. Baktēriju vielmaiņa .
Mikroorganismu fizioloģija ietver :
pārtikas veidi;
elpošanas veidi;
audzēšana (apstākļi, vide, raksturs un augšanas ātrums);
bioķīmiskā aktivitāte;
mainīgums;
bioloģiskā izolācija aktīvās vielas, toksīni un citi patogenitātes faktori;
jutība pret antibiotikām, bakteriofāgiem, bakteriocīniem;
citas bioloģiskās īpašības.
Baktēriju vielmaiņa - fizikālo un ķīmisko procesu kopums (ķīmiskas pārvērtības un reakcijas), kuru mērķis ir reproducēt struktūras un nodrošināt mikrobu šūnas dzīvībai svarīgās funkcijas, piemēram:
augšana un vairošanās;
rezerves pārtikas materiāla nogulsnēšanās;
barības vielu transportēšana mikrobu šūnā;
vielmaiņas produktu izdalīšanās (toksīni, fermenti, antibiotikas un citas bioloģiski aktīvas vielas);
kustība;
sporu veidošanās;
adhēzija uz jutīgiem saimniekšūnu receptoriem un iekļūšana tajos;
dažādas adaptīvās reakcijas uz ārējās vides izmaiņām.
Anabolisms- bioķīmisko reakciju kopums, kas veic šūnu komponentu sintēzi.
Katabolisms- reakciju kopums, kas nodrošina šūnu ar enerģiju.
Metabolisma pētījuma shēma – posmi:
1. Sākotnējā (perifērā) vielmaiņa - vielu iekļūšana šūnā no ārpuses un sabrukšana līdz starpproduktiem.
2. Amfibolisms (starpposma metabolisms) - starpproduktu vielmaiņas produktu veidošanās, kas ir kopīgi kataboliskajiem un anaboliskajiem ceļiem.
3. Pēdējie, stingri specializētie konstruktīvās vielmaiņas (noved pie šūnu struktūru uzbūves) un enerģijas metabolisma (ATP veidošanās) posmi.
Mehānismi barības vielu iekļūšanai šūnā:
Vienkārša difūzija (īstiem risinājumiem). enerģētiski neatkarīgs process.
Atvieglota difūzija ("tvaiks lejup pa straumi") - koncentrācijas gradienta virzienā, piedaloties nesējproteīniem. no enerģijas atkarīgs process.
Aktīvais transports ir pret koncentrāciju un elektroķīmisko gradientu, piedaloties permeāzēm (amino-, hidroksiskābi, jonu utt.). Process notiek ar ATP enerģijas patēriņu, ir atkarīgs no vielu lādiņa un to transformācijas pārneses procesā.
Mikroorganismus pēc spējas absorbēt oglekļa avotus iedala divās grupās: autotrofos (lat. automašīnas - sevi, trofeju - uzturs) sintezē visas šūnas oglekli saturošās sastāvdaļas no CO 2 kā vienīgā oglekļa un heterotrofu avota (lat. heteros - otrs, “barošana uz citu rēķina”) izmanto dažādus organisko oglekli saturošus savienojumus.
Atkarībā no enerģijas avotiem mikroorganismi tiek iedalīti arī fototrofos (fotosintētiskos), kas spēj izmantot saules enerģiju, un ķīmijtrofos (ķīmosintētiskajos), kas saņem enerģiju redoksreakciju ceļā.
Atkarībā no izmantotajiem elektronu donoriem baktērijas iedala litotrofos (izmantojot neorganiskos elektronu donorus) un organotrofos (izmantojot organiskos savienojumus).
Prototrofi- mikroorganismi, kas spēj sintezēt visus tiem nepieciešamos organiskos savienojumus no glikozes un amonija sāļiem.
Auksotrofi- mikroorganismi, kas nespēj sintezēt organiskos savienojumus. Viņi iegūst šos savienojumus gatavā veidā no vides vai cilvēka ķermeņa.
Fermenti(no grieķu. fermentum-sourdough) - ļoti specifiski proteīnu katalizatori, kas atrodas visās dzīvajās šūnās, bez kuriem nav iespējama dzīvība un vairošanās. Fermenti atpazīst savus attiecīgos metabolītus (substrātus), mijiedarbojas ar tiem un paātrina ķīmiskās reakcijas. Fermenti ir olbaltumvielas.
Mikroorganisma enzīmu sastāvu nosaka genoms, un tā ir diezgan stabila iezīme. Fermentu noteikšana tiek plaši izmantota baktēriju bioķīmiskai identificēšanai.
Endoenzīmi katalizē vielmaiņu šūnā.
Eksoenzīmus šūna izdala vidē.
Konstitūcijas fermenti tiek pastāvīgi sintezēti noteiktā koncentrācijā.
inducējams fermenti ir fermenti, kuru koncentrācija palielinās līdz ar atbilstošā substrāta uzņemšanu.
Agresijas enzīmi: hialuronidāze, fibrinolizīns, neiraminidāze, kolagenāze, lecitināze (licitovitellāze), koagulāze, ureāze, aminoskābju dekarboksilāzes, dezoksiribonukleāze.
audzēšana- mikroorganismu kultūru iegūšana mākslīgā barotnē.
Audzēšanas mērķi:
patogēno mikroorganismu tīrkultūru iegūšana un to identificēšana;
BAS ražotāju biomasas uzkrāšanās (vitamīni, hormoni, aminoskābes, antibiotikas u.c.);
diagnostisko un profilaktisko preparātu (vakcīnas, diagnostikas) iegūšana;
uzziņu muzeju kultūru glabāšana;
sanitārajā mikrobioloģijā noteikt sanitāri indikatīvos mikroorganismus - vides piesārņojuma rādītājus.
kultūra- mikroorganismu populācija, kas audzēta uz uzturvielu barotnes.
tīrā kultūra- viena veida mikroorganismu populācija, kas audzēta no izolētas kolonijas uz barotnes.
Lielākā daļa patogēno mikrobu tiek audzēti barotnēs 37°C temperatūrā 1-2 dienas.
Barotnes klasifikācija
Pēc konsekvences:šķidrs, pusšķidrs, blīvs.
Izcelsme: dabīgie (piens, kartupeļi), mākslīgie, daļēji sintētiskie, sintētiskie
Sastāvā: vienkāršs (MPA, MPB, dārzeņi, piens), komplekss (1% glikoze, 10-20% serums, 20-30% ascīts šķidrums, 5-10% defibrinētas asinis).
Pēc pieraksta:
universāls - barotne, kurā labi aug daudzu veidu baktērijas. Tie ietver gaļas-peptona buljonu (MPB) un gaļas-peptona agaru (MPA);
īpašs - barotne, kas īpaši sagatavota, lai iegūtu baktēriju vairošanos, kas neaug uz universālajām barotnēm;
diferenciāldiagnostika - vide, kas ļauj atšķirt viena veida baktērijas no citiem pēc fermentatīvās aktivitātes;
selektīvs - barotnes, kas satur vielas, ko izmanto noteiktu sugu mikroorganismi un novērš citu mikroorganismu augšanu. Selektīvā barotne ļauj atlasīt noteikta veida baktērijas no pētāmā materiāla;
diferenciāl-selektīva - vides, kas apvieno diferenciāldiagnostikas un selektīvās vides īpašības;
konservants;
koncentrējoties.
Baktēriju pavairošana uz šķidrām un blīvām barotnēm.
Izaugsme visu baktēriju šūnas komponentu koordinēta reprodukcija un tās biomasas palielināšanās. pavairošana- reprodukcija un šūnu skaita palielināšanās, kas izraisa baktēriju populācijas veidošanos.
Baktērijām raksturīgs augsts vairošanās ātrums. Vairošanās ātrums ir atkarīgs no sugas, barības barotnes sastāva, pH, temperatūras un aerācijas.
Uz blīvām barotnēm baktērijas veido šūnu kopas, ko sauc par kolonijām. Kolonijas dažādi veidi atšķiras pēc izmēra, formas, konsistences, krāsas, malu rakstura, virsmas rakstura, caurspīdīguma.
Augšanas raksturs uz šķidrām barotnēm: plēvīte (plēves veidošanās uz barības barotnes virsmas), difūzs duļķainums, gandrīz dibens (nokrišņi).
Baktēriju populācijas attīstības fāzes
Sākotnējā stacionārā fāze (~ 1-2 stundas). Baktēriju skaits nepalielinās, šūnas neaug.
Lag fāze vai vairošanās aizkavēšanās fāze (~ 2 stundas).
Log-fāze - logaritmiskā vai eksponenciālā fāze (~ 3-5h). Iedzīvotāji ir sadalīti maksimālais ātrums un indivīdu skaits pieaug eksponenciāli.
Negatīvā paātrinājuma fāze (~ 2 stundas). Saistīts ar ierobežojošā metabolīta samazināšanos vai toksisku vielmaiņas produktu uzkrāšanos.
Maksimuma stacionārā fāze. Izveidoto un mirstošo šūnu skaits ir vienāds.
Paātrinātās nāves fāze (~ 3 stundas).
Logaritmiskās nāves fāze (~5).
Mirstības samazināšanās fāze - atlikušie dzīvie indivīdi nonāk snaudošā stāvoklī.
Baktēriju enerģijas metabolisms
Aerobi- mikroorganismi, kas izmanto substrātu bioloģiskās oksidācijas aerobo (oksidatīvo) veidu. Aerobu vielmaiņa tiek veikta tikai augstas brīvā skābekļa koncentrācijas klātbūtnē biotopā, kas darbojas kā galīgais no substrāta ņemto elektronu akceptors. Aerobu kultivēšana tiek veikta barotnēs ar pilnu piekļuvi atmosfēras skābeklim.
obligātie anaerobi- mikroorganismi, kas izmanto bioloģiskās oksidācijas (fermentācijas) anaerobo veidu. Metabolisms notiek tikai vidēs ar zemu redokspotenciālu bez skābekļa.
Skābekļa koncentrācijas palielināšanās vidē izraisa veģetatīvo formu nāvi.
Fermentācijas laikā iegūtās enerģijas daudzums ir neliels, tāpēc obligātie anaerobi ir spiesti raudzēt lielu daudzumu substrāta.
Fakultatīvie anaerobi- mikroorganismi, kas spēj iegūt enerģiju no substrātiem, izmantojot bioloģiskās oksidācijas aerobo (oksidatīvo) un anaerobo (fermentatīvo) ceļu. Metabolismu var veikt gan pilnīgas skābekļa pieejamības apstākļos, gan anaerobiozes apstākļos.
Anaerobiozes veidošanas metodes
Fiziskā
sēšana cukura MPA kolonnā;
šķidro uzturvielu barotnes vārīšana (reģenerācija), kam seko eļļas pārklāšana;
mehāniska skābekļa noņemšana anaerostatos;
skābekļa aizstāšana ar vienaldzīgu gāzi;
Veillon-Vignal caurules.
Ķīmiskā
Aristovska aparāts;
Omeljanska svece (pirogalola sārma šķīdums);
ķīmisko skābekļa akceptoru izmantošana: glikoze, pirovīnskābe, nātrija skudrskābe utt.
Bioloģiskā
Kitta-Tarozzi trešdiena
Fortnera metode
Anaerobi - organismi, kas iegūst enerģiju, ja nav piekļuves skābeklis pēc substrāta fosforilēšana , substrāta nepilnīgas oksidācijas galaproduktus var oksidēt ar vairāk enerģijas formāATP gala protonu akceptora klātbūtnē ar organismiem, kas .
Anaerobā elpošana- agregāts bioķīmiskās reakcijas, kas rodas dzīvo organismu šūnās, ja to izmanto kā galīgo protonu akceptoru, tā nav skābeklis un citas vielas (piemēram, nitrāti) un attiecas uz procesiem enerģijas metabolisms(katabolisms,disimilācija), kuras raksturo oksidēšanāsogļhidrāti,lipīdi Un aminoskābes zemas molekulmasas savienojumiem.
BET 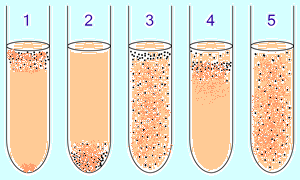 aerobās un anaerobās baktērijas tiek provizoriski identificētas šķidrā barotnē pēc O2 koncentrācijas gradienta:
aerobās un anaerobās baktērijas tiek provizoriski identificētas šķidrā barotnē pēc O2 koncentrācijas gradienta:
1. obligāta aerobika(skābeklis nepieciešams) baktērijas galvenokārt tiek savāktas caurules augšpusē, lai absorbētu maksimālo skābekļa daudzumu. (Izņēmums: mikobaktērijas — plēves augšana uz virsmas vaska-lipīdu membrānas dēļ.)
2. obligāts anaerobs baktērijas sakrājas apakšā, lai izvairītos no skābekļa (vai neaugtu). 3. Fakultatīvās baktērijas tiek savākti galvenokārt augšējā ( oksidatīvā fosforilēšana ir labvēlīgāka par glikolīzi), tomēr tos var atrast visā vidē, jo tie nav atkarīgi no O 2. 4 . mikroaerofili tiek savākti caurules augšējā daļā, bet to optimālā ir zema skābekļa koncentrācija. pieci. Aerotolerants anaerobi nereaģē uz skābekļa koncentrāciju un ir vienmērīgi sadalīti visā mēģenē.
D  mērīšanai jaudu vides M. Klārks ierosināts izmantot pH20 vērtību - negatīvs logaritmsdaļējs spiediens gāzveida ūdeņradis. Diapazons raksturo visas piesātinājuma pakāpes ūdens šķīdumsūdeņradis un skābeklis. Aerobi aug ar lielāku potenciālu, fakultatīvie anaerobi, bet obligātie – ar zemāko potenciālu.)
mērīšanai jaudu vides M. Klārks ierosināts izmantot pH20 vērtību - negatīvs logaritmsdaļējs spiediens gāzveida ūdeņradis. Diapazons raksturo visas piesātinājuma pakāpes ūdens šķīdumsūdeņradis un skābeklis. Aerobi aug ar lielāku potenciālu, fakultatīvie anaerobi, bet obligātie – ar zemāko potenciālu.)
Anaerobu klasifikācija, atšķirt:
Fakultatīvie anaerobi
Kapneistiskie anaerobi un mikroaerofīli
Aerotoleranti anaerobi
Vidēji stingri anaerobi
obligātie anaerobi
Ja organisms spēj pārslēgties no viena vielmaiņas ceļa uz citu (piemēram, no anaerobās elpošanas uz aerobikas un otrādi), tad to nosacīti dēvē par fakultatīviem anaerobiem .
Līdz 1991. gadam mikrobioloģijā tika izdalīta kapneistisku anaerobu klase, kam bija nepieciešama samazināta koncentrācija. skābeklis un paaugstināta oglekļa dioksīda koncentrācija (Brucella bovine tips - B. abortus)
Bakterioloģiskās metodes izmantošana ļauj izolēt patogēnu tīrkultūrā no materiāla, kas iegūts no pacienta, un identificēt to, pamatojoties uz īpašību kompleksa izpēti. Lielākā daļa baktēriju ir spējīgas kultivēt uz dažādām mākslīgām barotnēm (izņemot hlamīdijas un riketsijas), tāpēc bakterioloģiskā metode ir svarīga daudzu infekcijas slimību diagnostikā.
Ja tiek iegūts pozitīvs rezultāts, bakterioloģiskā metode ļauj noteikt izolētā patogēna jutību pret pretmikrobu zālēm. Tomēr šī pētījuma efektivitāte ir atkarīga no daudziem parametriem, jo īpaši no savākšanas nosacījumi un viņa transportēšana uz laboratoriju.
UZ pamatprasības prasības materiāla atlasei un transportēšanai bakterioloģiskai izmeklēšanai ietver:
- materiāla ņemšana pirms etiotropās ārstēšanas sākuma;
- sterilitātes nosacījumu ievērošana, vācot materiālu;
- materiālu savākšanas tehniskā pareizība;
- pietiekams materiāla daudzums;
- materiāla uzglabāšanas un transportēšanas temperatūras režīma nodrošināšana;
- laika intervāla samazināšana līdz minimālajam laika intervālam starp materiāla savākšanu un sēšanu blīvā barotnē.
Materiāla transportēšana uz laboratoriju jāveic pēc iespējas ātrāk, bet ne ātrāk kā 1-2 stundu laikā pēc tā ņemšanas. Materiāla paraugiem jābūt noteiktā temperatūrā; jo īpaši parasti sterilus materiālus (asinis, cerebrospinālais šķidrums) uzglabā un nogādā laboratorijā 37 °C temperatūrā. Nesterilus materiālus (urīnu, elpceļu izdalījumus u.c.) uzglabā istabas temperatūrā ne ilgāk kā 1-2 stundas vai ne ilgāk par dienu 4 °C (sadzīves ledusskapja apstākļi). Ja noteiktajā termiņā paraugus nogādāt laboratorijā nav iespējams, ieteicams izmantot transportēšanas līdzekļus, kas paredzēti patogēnu dzīvotspējas saglabāšanai konservācijas apstākļos.
Asinis pētniecībai jāņem no pacienta ķermeņa temperatūras paaugstināšanās laikā, drudža sākumā. Ieteicams izmeklēt 3-4 asins paraugus, kas ņemti ar 4-6 stundu intervālu, kas ir saprātīgi, lai samazinātu pārejošas bakterēmijas "pazušanas" risku un palielinātu spēju apstiprināt no oportūnistiskās mikrofloras etioloģisko lomu, kas izolēta no asinis, ja šī mikroflora ir konstatēta vairākos venozo asiņu paraugos. Asins paraugs 10 ml pieaugušajiem un 5 ml bērniem tiek inokulēts vismaz divos flakonos ar barotni aerobiem un anaerobiem mikroorganismiem proporcijā 1:10. Vēlams arī viens arteriālo asiņu pētījums.
Ņem cerebrospinālais šķidrums(CSJ) ražo ārsts ar lumbālpunkciju 1-2 ml apjomā sausā sterilā mēģenē. Paraugs nekavējoties tiek nogādāts laboratorijā, kur nekavējoties tiek uzsākta arī tā izpēte. Ja tas nav iespējams, materiālu vairākas stundas uzglabā 37 °C temperatūrā. Ievērojami palielina bakterioloģiskās izmeklēšanas pozitīvo rezultātu skaitu, iesējot 1-2 pilienus CSF mēģenē, kurā ir pusšķidra barotne ar glikozi, un Petri trauciņā ar "asins" agaru. Materiāla nosūtīšanai tiek izmantotas izotermiskas kastes, sildīšanas paliktņi, termosi vai jebkurš cits iepakojums, kurā tiek uzturēta aptuveni 37 ° C temperatūra.
Ekskrementi bakterioloģiskai izmeklēšanai tos ar sterilām koka lāpstiņām 3-5 g apjomā ņem sterilā traukā ar cieši noslēgtu vāku. Paņemtā materiāla izpēte jāuzsāk ne vēlāk kā 2 stundas vēlāk.Ja šajā laikā nav iespējams uzsākt izpēti, jāņem neliels materiāla daudzums un jāievieto atbilstošā transporta vidē. Izvēloties izkārnījumus, jācenšas nosūtīt patoloģiskus piemaisījumus (gļotas, strutas, epitēlija daļiņas u.c.) pētniecībai, ja tādi ir, izvairoties no asins piemaisījumu ar baktericīdām īpašībām iekļūšanas materiālā.
Materiāla paņemšanai var izmantot taisnās zarnas tamponus (ar vates galu). Tampons jāsamitrina sterilā izotoniskā nātrija hlorīda šķīdumā vai transportēšanas vidē (nevis eļļas gēlā). To ievada taisnajā zarnā 5-6 cm dziļumā un, pagriežot tamponu, uzmanīgi noņemiet to, kontrolējot fekāliju krāsas parādīšanos uz tampona. Tamponu ievieto sausā mēģenē, ja materiāla izpēte tiek uzsākta 2 stundu laikā, pretējā gadījumā - transportēšanas vidē.
Urīns(vidēja brīvi izdalītā urīna porcija) 3-5 ml apjomā tiek savākti sterilā traukā pēc rūpīgas ārējo dzimumorgānu tualetes. Vēlams uzņemt urīna porcijas no rīta.
Žults kas savākti divpadsmitpirkstu zarnas zondēšanas laikā procedūru telpa atsevišķi A, B un C daļās trīs sterilās mēģenēs, ievērojot aseptikas noteikumus.
Nomazgājiet kuņģa ūdeni savākti sterilās burkās 20-50 ml apjomā. Jāpatur prātā, ka kuņģa skalošana šajos gadījumos tiek veikta tikai ar vienaldzīgiem (nav bakteriostatiskas vai baktericīdas iedarbības uz mikroorganismiem) šķīdumiem - vēlams vārītu ūdeni (bez sodas, kālija permanganāta u.c. pievienošanas).
Krēpas. Rīta krēpas, kas izdalās klepus lēkmes laikā, tiek savāktas sterilā burkā. Pacients pirms klepus iztīra zobus un izskalo muti ar vārītu ūdeni, lai mehāniski noņemtu pārtikas atliekas, atslāņojušos epitēliju un mutes dobuma mikrofloru.
Bronhu skalošanas ūdens. Bronhoskopijas laikā injicē ne vairāk kā 5 ml izotoniskā nātrija hlorīda šķīduma, kam seko iesūkšana sterilā mēģenē.
Izdalījumi no rīkles, mutes dobuma un deguna. Materiālu no mutes dobuma ņem tukšā dūšā vai 2 stundas pēc ēšanas ar sterilu vates tamponu vai karoti no gļotādas un tās skartajām vietām pie siekalu dziedzeru kanālu ieejām, mēles virsmas, no čūlām. Ja ir plēve, to noņem ar sterilu pinceti. Materiālu no deguna dobuma ņem ar sausu sterilu vates tamponu, kas tiek ievietots dziļi deguna dobumā. Materiālu no nazofarneksa ņem ar sterilu aizmugures rīkles vates tamponu, ko uzmanīgi ievada caur deguna atveri nazofarneksā. Ja tajā pašā laikā sākas klepus, tamponu noņem tikai tad, kad klepus beidzas. Lai veiktu difterijas analīzi, vienlaikus tiek pārbaudītas plēves un gļotas no deguna un rīkles, ņemot materiālu ar dažādiem tamponiem.
Testa materiālu inokulē uz blīvām barotnēm, izmantojot īpašus paņēmienus, lai iegūtu atsevišķu mikroorganismu koloniju augšanu, kuras pēc tam izsijā, lai izolētu patogēna tīrkultūru.
Atsevišķu veidu baktērijas tiek izolētas, izmantojot selektīvo (selektīvo) barotni, kas aizkavē svešu mikroorganismu augšanu vai satur vielas, kas stimulē noteiktu patogēno mikrobu augšanu.
Uz barības vielu barotnes izolēti mikroorganismi identificēt, t.i. noteikt to sugu vai veida piederību. Pēdējā laikā identifikācijai veselības aprūpes praksē tiek izmantotas mikrotestu sistēmas, kas ir paneļi ar diferenciāldiagnostikas vidi, kas paātrina pētījumu. Mikrotestu sistēmas tiek izmantotas arī, lai noteiktu mikroorganismu jutību pret pretmikrobu zālēm, atšķaidot antibiotiku šķidrā barotnē.
Izvērtējot bakterioloģiskā pētījuma rezultātus, ārstam jāņem vērā, ka negatīvs rezultāts ne vienmēr nozīmē patogēna neesamību un var būt saistīts ar pretmikrobu zāļu lietošanu, augstu asins mikrocīdo aktivitāti, tehniskām kļūdām. Patogēna mikroba noteikšana materiālā no pacienta, kas nav saistīts ar klīniskā aina iespējams atveseļošanās, veselīgu vai pārejošu baktēriju pārnēsāšanas gadījumā.
Nosacīti patogēnu mikroorganismu (Staphylococcus epidermidis, Escherichia coli) un pat saprofītu izolēšana no asinīm, ievērojot visus aseptikas noteikumus, jāuzskata par bakterēmijas izpausmi, īpaši, ja šie mikrobi ir atrodami vairāk nekā vienā materiāla paraugā vai dažādos substrātos ( asinis, urīns), kopš organisma imūnreaktivitātes samazināšanās, šie un citi "nepatogēnie" mikroorganismi var būt infekcijas procesu, tostarp sepses, izraisītāji.
Zināmas grūtības ir nesterilu barotņu bakterioloģiskās izmeklēšanas rezultātu interpretācija, proti, oportūnistisko mikroorganismu etioloģiskās lomas pierādījums. Šajā gadījumā tiek ņemti vērā tādi rādītāji kā izolēto kultūru veids, noteiktā tipa mikrobu šūnu skaits materiālā, to atkārtota izolēšana slimības gaitā, monokultūras vai mikroorganismu asociācijas klātbūtne. konts kompleksā.
Juščuks N.D., Vengerovs Yu.Ya.
Bakterioloģiskās izpētes metode. Patogēna izdalīšana no asinīm (hemokultūra) ir agrīna slimību diagnostikas metode. Bakterēmija pacientiem ar vēdertīfu-paratīfu parādās beigās inkubācijas periods un nepazūd visā slimības drudža periodā un recidīvu laikā. Bakterioloģiskās izmeklēšanas rezultāti zināmā mērā ir atkarīgi no materiāla savākšanas laika un inokulētā asins daudzuma. Jo agrāk tiek veikta asins kultūra no slimības sākuma, jo lielāka iespējamība atklāt patogēnu. Pirmajā vēdertīfa nedēļā pacientam asinis no kubitālās vēnas ņem 10 ml apjomā, vēlāk un recidīvu laikā - 20 ml.
Pirmajā mācību dienā asinis proporcijā 1:10 inokulē vienā no šķidrajām barotnēm. Norādītā attiecība ir stingri jāievēro, jo ar mazāku asiņu atšķaidīšanu mikrobi var nomirt tā baktericīdās iedarbības dēļ. Sēšanai izmanto: 10% vai 20% žults buljona šķīdumu, kas ielej 50-100 ml pudelēs, gaļas-peptona buljonu, pievienojot 1% glikozes, sterilu destilētu ūdeni - saskaņā ar NN Klodņitska metodi, kurā notiek eritrocītu līze, to sabrukšanas produkti vienlaikus kalpo kā laba barības vide baktēriju pavairošanai. Varat arī izmantot sterilu krāna ūdeni. Vislabākos rezultātus iegūst, uzsējot materiālu uz žults buljonu. Ja uz vietas nav iespējams veikt asins kultūru, serumu kopā ar recekli vai citrātām asinīm (10 ml asiņu ielej mēģenē ar 2 ml 5% sterila nātrija citrāta) nosūta uz laboratoriju. Asins receklis tiek sasmalcināts laboratorijā un inokulēts vienā no uzskaitītajām barotnēm. Flakonus ievieto termostatā 37 ° C temperatūrā.
Otrā pētījuma diena. Pēc 14-24 stundām no pētījuma sākuma materiāls tiek inokulēts Petri trauciņā uz Endo barotnes vai barotnes ar eozīnu un metilēnzilu (Levin barotni). Ploskireva barotni nav ieteicams lietot sējai, jo vēdertīfa-paratīfa baciļi asinīs ir obligāti paratrofi pēc uztura veida un nekavējoties nemaina šo uztura veidu uz metatrofiskiem (tas ir, mirušiem organiskiem substrātiem). Tāpēc uz šīs žults sāļus saturošās barotnes vēdertīfa baciļi aug ļoti vāji vai neaug vispār. Ja pēc pirmās sēšanas nav baktēriju vairošanās, nākamās tiek ražotas pēc 48, 72 stundām un 5. un 10. dienā. Ja tajā pašā laikā patogēnu nevarēja izolēt, tiek sniegta noraidoša atbilde. Apšaubāmos gadījumos ieteicams periodiski - 1 reizi 3-4 dienās - ražot ražu līdz 24. dienai no materiāla ņemšanas brīža. Noraidoša atbilde joprojām tiek sniegta 7. dienā.
Trešā pētījuma diena. Tiek identificētas “aizdomīgas” kolonijas, kas audzētas uz Endo un Levin barotnēm (patogēno mikrobu kolonijas Endo barotnē ir bezkrāsainas), kurām 2-3 kolonijas tiek subkultivētas uz slīpā agara un Ressel barotnes.
Ceturtā pētījuma diena. Inokulācijas rezultāti uz Ressel barotnes tiek ņemti vērā un reģistrēti, izolēto kultūru morfoloģiskās īpašības tiek pētītas ar Grama krāsotu uztriepi. Mobilitāti nosaka – flagella esamību vai neesamību – nokarenā vai sasmalcinātā pilē, kas ņemta no 4-6 stundu buljona kultūras. Lai to izdarītu, agara kultūru (vienu cilpu) inokulē 1 ml nedaudz uzsildīta buljona. Atlasītās kultūras (2-3 mēģenes) subkultivē Giss barotnē ar mannītu, saharozi un slīpo agaru, kā arī 2 mēģenēs ar gaļas-peptona buljonu, kurā filtrpapīra strēmeles, kas samitrinātas ar speciāliem ūdeņraža noteikšanas šķīdumiem. zem aizbāžņiem novieto sulfīdu un indolu (izlocīta "raiba rinda").
Piektā pētījuma diena. Izmaiņas tiek reģistrētas paplašinātajā "raibajā rindā". Gāzu veidošanās klātbūtnē tiek veikta aglutinācijas reakcija ar salmonellas serumu maisījumu. Plkst pozitīva reakcija veikt aglutinācijas reakciju ar O- un H-serumiem un sniegt galīgo atbildi, pamatojoties uz visu pazīmju kopumu.
Mielokultūras izolāciju veic, iegūto kaulu smadzeņu punktotu inokulējot 3-5 ml sterilā liellopu žults vai 25-30 ml 10% žults buljonā, ievietojot termostatā un nākamajā dienā atkārtoti iesējot uz Endo vai Vilsona-Blēra mediji. Nākotnē pētījumu posmi ir vienādi.
Baktēriju izolēšana no izkārnījumiem. No 8. līdz 10. slimības dienai, biežāk no trešās nedēļas, pacientiem ar vēdertīfu paratīfa baktērijas izdalās ar izkārnījumiem. Pētījumiem tiek ņemtas pēdējās šķidro fekāliju porcijas, emulģētas izotoniskā nātrija hlorīda šķīdumā (attiecībā 1:10) un atstātas 30 minūtes, līdz nosēžas lielas daļiņas. Sēšanai no šķidruma virsmas ņem materiāla pilienu.
Pirmajā pētījuma dienā materiāls tiek inokulēts uz bagātināšanas barotnēm - žults buljons, magnija barotne, Muller, Kaufman - un ievietots termostatā. Pētījuma otrajā dienā no bagātināšanas barotnes uz plāksnēm veic inokulāciju ar Ploskirev, Endo vai Levin un Wilson-Blair barotni (bismuta-sulfīta-agaru). Turpmākie pētījuma posmi ir tādi paši kā asins kultūras izolēšanai.
Tīfa-paratīfa grupas baktēriju izdalīšanu no urīna vislabāk var veikt no otrās līdz trešās slimības nedēļas. Pirms materiāla ņemšanas urīnizvadkanāla ārējā atvere jānomazgā ar sterilu izotonisku nātrija hlorīda šķīdumu; sievietēm urīnu labāk ņemt ar katetru. Pētījumiem ņem 20-30 ml urīna. Pēc centrifugēšanas nogulsnes inokulē 2 tasītēs ar Ploskireva barotni vai bismuta-sulfīta agaru. Supernatantu inokulē uz bagātināšanas barotnes (10% žults buljona) un ievieto termostatā uz 24 stundām, pēc tam to inokulē 2 tasītēs vienas no izvēlētajām barotnēm. Izolētās kolonijas tiek identificētas parastajā veidā.
Divpadsmitpirkstu zarnas satura pārbaude - žults. Metode biežāk tiek izmantota atveseļošanās stadijā. Žults tiek savākta zondēšanas laikā sterilās mēģenēs. Divpadsmitpirkstu zarnas saturu inokulē flakonos ar 50 ml buljona, un pārējo materiālu kopā ar potēm ievieto termostatā 37 ° C. Nākamajā dienā inokulāciju veic 2 tasītēs ar blīvu diferenciālo barotni. . Atlasītās kolonijas identificē ar aprakstīto metodi.
Ļoti jutīga un perspektīva vēdertīfa un paratīfa agrīnā diagnostikā ir imunofluorescences metode, kas izmeklē asinis no pirmajām slimības dienām, izkārnījumus no 10. dienas, divpadsmitpirkstu zarnas saturu 10. dienā. normāla temperatūraķermenis. Tīfa-paratīfa baktērijas ir marķētas ar specifiskiem fluorescējošiem serumiem, kurus pēc tam nosaka ar fluorescējošu mikroskopiju. Metode ļauj diagnosticēt slimību 10-12 stundu laikā no pētījuma sākuma.
Vēdertīfa un paratīfa slimību seroloģiskā diagnostika. Sākot ar otro slimības nedēļu, pacientu asinīs parādās specifiskas antivielas, kuras var noteikt, izmantojot Vidala reakciju. Tīfa un paratīfa gadījumā uzkrājas O- un pēc tam H-aglutinīni. Slimības gaitā dažkārt tiek konstatēti arī Vi-aglutinīni, bet pēdējiem atšķirībā no nesējiem nav diagnostiskas vērtības. Specifisku aglutinīnu noteikšana pacientu asinīs pret vēdertīfa un paratīfa izraisītāju (Vidal reakcija) var palīdzēt noteikt diagnozi gan slimības akūtā periodā, gan atveseļošanās periodā.
Salmonelozes gadījumā Vidala reakcija ir papildu diagnostikas metode. Jāatceras, ka bieži vien ir slimības formas ar vieglu imunoloģisku reakciju. Īpaši bieži ar antibiotikām ārstētiem pacientiem tiek novēroti zemi aglutinīnu titri līdz pat to neesamībai.
Vidala reakcijai sterilā mēģenē ņem 1-3 ml asiņu no pirksta vai kubitālās vēnas. Lai paātrinātu asins recēšanu, to ievieto termostatā uz 30 minūtēm. Sarecējušās asinis apviļā ar stikla pipeti un ievieto ledusskapī, līdz parādās dzidrs, nosēdināts serums. Trombu izmanto sēšanai (hemokultūrai). Aglutinācijas reakcija tiek veikta ar H- un O-tīfa, A- un B-paratīfa diagnostiku. Serumu atšķaida, sākot ar titru no 1:100 līdz 1:800, saskaņā ar šādu metodi. Mēģenē ielej 9,9 ml sterila izotoniskā nātrija hlorīda šķīduma un 0,1 ml testa seruma - iegūst atšķaidījumu 1:100. 4 mēģenēs (atbilstoši Vidala reakcijā izmantoto antigēnu skaitam) un vienā porcijā kā seruma kontrolei 5 ml atšķaidīta seruma ielej 1 ml. No atlikušajiem 5 ml seruma (atšķaidījums 1:100) ielej 1 ml, un 4 ml pievieno 4 ml izotoniskā nātrija hlorīda šķīduma un iegūst atšķaidījumu 1:200. 4 ml no atšķaidījuma 1:200 arī ielej 4 mēģenēs pa 1 ml katrā, un atlikušajiem 4 ml atkal pievieno 4 ml izotoniskā nātrija hlorīda šķīduma, lai iegūtu atšķaidījumu 1:400. Turpmākos atšķaidījumus (1:800, 1:1600) veic aprakstītajā veidā. 4 mēģenēs, kas ir kontroles antigēni, ielej 1 ml izotoniskā nātrija hlorīda šķīduma. Visās eksperimentālajās mēģenēs, izņemot tās, kas kalpo kā seruma kontrole, ielej 1-2 pilienus atbilstošās diagnostikas. Plauktu ar mēģenēm sakrata un uz 24 stundām ievieto termostatā 37 ° C. H-aglutinācija (rupji graudaina) notiek pēc 2 stundām, O-aglutinācija (smalki graudaina) - daudz vēlāk. Reakcijas intensitāte tiek atzīmēta pēc 24 stundām Vidāla reakcijas diagnostiskais titrs atšķaidījumā vismaz 1:200 klīnisku izpausmju klātbūtnē.
Jāpatur prātā, ka šī reakcija var būt pozitīva arī pie citām slimībām – tuberkulozes, malārijas, brucelozes, ļaundabīgiem audzējiem un noteiktiem stāvokļiem (grūtniecība). Vidala reakcija var būt pozitīva arī veseliem indivīdiem (sadzīves reakcija), vakcinētiem un iepriekš bijusi slimība (anamnestiskā reakcija). Lai palielinātu Vidal reakcijas specifiku, Fišers ieteica serumu atšķaidīt ar hipertonisku nātrija hlorīda šķīdumu (2,9 un 5,8%). Tas noved pie grupu reakciju vājināšanās vai izzušanas. Aglutinācijas reakcijas vērtība palielinās ar atkārtotiem pētījumiem, kad ar slimības dinamiku tiek konstatēts antivielu titra pieaugums. Ar paratīfu A Vidala reakcija var būt negatīva vai specifisko antivielu titrs ir mazāks nekā grupā.
Pēdējos gados, lai atpazītu zarnu slimību grupu, plaši tiek izmantota pasīvās hemaglutinācijas (RPHA) reakcija ar vēdertīfa baktēriju daļējiem antigēniem. RPHA ir uzlieta ar augstu jutību un specifiskumu, tā ir pozitīva no 5. slimības dienas. Minimālais diagnostikas titrs pacientiem ar vēdertīfu, paratīfu, salmonelozi ar O-antigēnu ir 1:200. Reakcija tiek ievietota dinamikā, lai noteiktu antivielu titra pieaugumu.
Bakterionēra laboratoriskās diagnostikas metodes vēdertīfa un paratīfa gadījumā. Izkārnījumu, urīna un divpadsmitpirkstu zarnas satura bakterioloģiskā izmeklēšana tiek veikta saskaņā ar vispārpieņemtām metodēm. Vislabākos rezultātus iegūst, izmantojot selenītu.
Sakarā ar baktēriju izolācijas biežumu, bieži vien nav iespējams iesēt patogēnu. Lielākajā daļā vēdertīfa baciļu pārnēsātāju tiek atrasti mikrobi, kas satur Vi-antigēnu, un tāpēc Vi-antivielas parādās akūtu un hronisku nesēju asinīs (tās ir retāk sastopamas pacientu asinīs). Reakcijas diagnostikas titrs ir 1:20 un vairāk. Paralēli Vi-aglutinācijas reakcijai (ar uzsildītu serumu) ar H- un O-tīfa diagnostiku tiek veikta Vidala reakcija (ar native serumu). Vēdertīfa baktēriju nesēju serumā H-antivielas titrā no 1:200 līdz 1:800 tiek konstatētas 60-80% gadījumu. H- un Vi-antivielu kombinācijas klātbūtnei ir īpaša diagnostiskā vērtība, nosakot vēdertīfa baciļu nesējus.
No papildu izpētes metodēm vēdertīfa baciļu pārnēsāšanas identificēšanai izmanto ādas alerģisko testu ar tīfīnu, kā arī RPHA ar Vi antigēnu.
Tādējādi svarīgs nosacījums veiksmīgai cīņai pret vēdertīfu-paratīfu slimībām ir agrīna un pilnīga infekcijas avota noteikšana un neitralizācija. Pašlaik vēdertīfs notiek sporādiski. Tajā pašā laikā slimības gaita ir mazāk ilga un tai nav pievienotas visas klasiskajai formai raksturīgās pazīmes, kas apgrūtina klīnisko atpazīšanu.
Saistībā ar iepriekš minēto liela nozīme ir visaptverošai laboratoriskai izmeklēšanai.
Bakterioloģiskās izpētes metode (BLMI)- metode, kuras pamatā ir baktēriju tīrkultūru izdalīšana, kultivējot uz barības vielu barotnēm, un to identificēšana ar sugām, pamatojoties uz mikroorganismu morfoloģisko, kultūras, bioķīmisko, ģenētisko, seroloģisko, bioloģisko, ekoloģisko īpašību izpēti.
Infekciju bakterioloģiskā diagnostika tiek veikta, izmantojot Veselības ministrijas apstiprinātas standarta diagnostikas shēmas.
Tīra kultūra - tās pašas sugas baktērijas, kas audzētas uz barotnes, kuru īpašības tiek pētītas.
Celms- identificēta vienas sugas mikroorganismu tīrkultūra, kas izolēta no noteikta avota noteiktā laikā. Vienas sugas celmi var nebūtiski atšķirties pēc bioķīmiskajām, ģenētiskajām, seroloģiskajām, bioloģiskajām un citām īpašībām, kā arī pēc izolēšanas vietas un laika.
BLMI mērķi:
1. Etioloģiskā diagnoze: mikroorganismu tīrkultūras izdalīšana un identifikācija.
2. Papildus īpašību noteikšana, piemēram, mikroorganisma jutība pret antibiotikām un bakteriofāgiem.
3. Mikroorganismu skaita noteikšana (svarīga UPM izraisīto infekciju diagnostikā).
4. Mikroorganismu tipizēšana, t.i., intraspecifisku atšķirību noteikšana, pamatojoties uz pētījumu. ģenētiskais Un epidemioloģiskā(fagovāri un serovāri) marķieri. To izmanto epidemioloģiskiem nolūkiem, jo ļauj noteikt no dažādiem pacientiem un no dažādiem ārējās vides objektiem izolētu mikroorganismu kopību dažādās slimnīcās, ģeogrāfiskos reģionos.
BLMI ietver vairākus posmus, atšķiras aerobiem, fakultatīvajiem anaerobiem un obligātajiem anaerobiem.
I. BLMI stadijas aerobu un fakultatīvo anaerobu tīrkultūras izolācijā.
Skatuves.
A. Savākšana, transportēšana, uzglabāšana, Iepriekšēja apstrāde materiāls. Dažreiz pirms sēšanas tiek veikta materiāla selektīva apstrāde, ņemot vērā izolētā mikroorganisma īpašības. Piemēram, pirms krēpu vai cita materiāla pārbaudes, lai noteiktu, vai nav skābes izturīgas Mycobacterium tuberculosis, materiālu apstrādā ar skābes vai sārmu šķīdumiem.
B. Sēšana bagātināšanas vidē(ja nepieciešams).To veic, ja testa materiāls satur nelielu daudzumu baktēriju, piemēram, izolējot asins kultūru. Lai to izdarītu, asinis, kas ņemtas drudža laikā lielā apjomā (8-10 ml pieaugušajiem, 4-5 ml bērniem), tiek inokulētas barotnē proporcijā 1:10 (lai pārvarētu asins baktericīdo iedarbību faktori); sējumu inkubē 37 0 C temperatūrā 18-24 stundas.
B. Pārbaudāmā materiāla mikroskopija. No testa materiāla sagatavo uztriepi, iekrāso ar Grama vai citu metodi un mikroskopē. Novērtē esošo mikrofloru, tās daudzumu. Turpmākās izpētes gaitā primārajā uztriepē esošie mikroorganismi jāizolē.
G. Sēšana uz barotnes, lai iegūtu izolētas kolonijas. Materiālu inokulē ar cilpu vai lāpstiņu, mehāniski atdalot uz plāksnes ar diferenciāldiagnostikas vai selektīvu barotni, lai iegūtu izolētas kolonijas. Pēc sēšanas trauku apgriež otrādi (lai nesasmērētu kolonijas ar kondensāta šķidruma pilieniņām), paraksta un ievieto termostatā 37 0 C temperatūrā uz 18-24 stundām.
Jāatceras, ka, sējot un pārsējot mikrobu kultūras, jāvērš strādnieka uzmanība uz aseptikas noteikumu ievērošanu, lai novērstu uzturvielu barotņu inficēšanos un novērstu apkārtējo inficēšanos un pašinfekciju!
Oportūnistisku mikroorganismu izraisītu infekciju gadījumā, kad svarīgs ir patoloģiskajā materiālā esošo mikroorganismu skaits, tiek veikta materiāla kvantitatīvā inokulācija, kurai sagatavo 100-kārtīgu materiāla atšķaidījumu sēriju (parasti 3 atšķaidījumus). sterilā izotoniskā nātrija hlorīda šķīdumā mēģenēs. Pēc tam 50 μl katra atšķaidījuma iesēj uz barības vielu barotnēm Petri trauciņos.
Skatuves.
A. Koloniju morfotipu izpēte uz barotnēm, to mikroskopija. Viņi izskata traukus un atzīmē optimālo barotni, augšanas ātrumu un mikroorganismu augšanas raksturu. Izvēlieties studēt izolētas kolonijas, kas atrodas gar insultu, tuvāk centram. Ja aug vairāku veidu kolonijas, katru izmeklē atsevišķi. Novērtējiet koloniju pazīmes (7. tabula). Ja nepieciešams, traukus ar kultūrām skatās caur palielināmo stiklu vai izmantojot mikroskopu ar maza palielinājuma lēcu un sašaurinātu apertūru. Viņi pēta dažādu koloniju morfotipu tintoriālās īpašības, šim nolūkam tiek sagatavota daļa no pētāmās kolonijas. smērēt, iekrāso ar Grama vai citām metodēm, mikroskopiski un nosaka kultūras tīrības morfoloģiju.Ja nepieciešams, ielieciet indikatīvs RA uz stikla ar polivalentiem serumiem.
B. Tīrkultūras uzkrāšana. Lai uzkrātu tīrkultūru, visu morfotipu izolētas kolonijas subkultivē atsevišķās mēģenēs ar slīpo agaru vai kādu citu barotni un inkubē termostatā +37 0 C temperatūrā (šī temperatūra ir optimāla lielākajai daļai mikroorganismu, taču tā var būt dažāda, piemēram, priekš Campylobacterium spp.- +42 0 C, Candida spp. un Yersinia pestis- +25 0 C).
Kliglera barotni parasti izmanto kā enterobaktēriju uzkrāšanās barotni.
Kliglera medija sastāvs: MPA, 0,1% glikoze, 1% laktoze, sērūdeņraža reaģents (dzelzs sulfāts + nātrija tiosulfāts + nātrija sulfīts), fenolsarkanais indikators. Barotnes sākotnējā krāsa ir aveņsarkana, mēģenēs barotne ir “slīpa”: tai ir kolonna (2/3) un slīpa virsma (1/3).
Sēšana Kliglera vidē tiek veikta, uzspiežot uz virsmas un ievadot kolonnā.
Skatuves.
A. Augšanas uz akumulācijas barotnes uzskaite, kultūras tīrības novērtējums grama uztriepē. izaugsmes modeļi izolēta tīrkultūra. Vizuāli tīru kultūru raksturo vienmērīga augšana. Plkst mikroskopiskā izmeklēšana no šādas kultūras sagatavota iekrāsota uztriepe, tajā dažādos redzes laukos atrodamas morfoloģiski un tintoriāli viendabīgas šūnas. Tomēr izteikta pleomorfisma gadījumā, kas raksturīgs dažiem baktēriju veidiem, tīrkultūras uztriepes vienlaikus var parādīties šūnas ar atšķirīgu morfoloģiju.
Ja par akumulācijas vidi tika izmantota Kliglera indikatorvide, tad tiek novērtētas tās krāsas izmaiņas kolonnā un slīpajā daļā, pēc kurām nosaka bioķīmiskās īpašības: glikozes, laktozes fermentāciju un sērūdeņraža veidošanos. Sadaloties laktozei, barotnes slīpā daļa kļūst dzeltena, sadaloties glikozei, kolonna kļūst dzeltena. Cukuru sadalīšanās laikā veidojas CO 2, veidojas gāzes burbuļi vai kolonnas pārrāvums. Sērūdeņraža ražošanas gadījumā tiek novērota melnēšana injekcijas laikā, jo dzelzs sulfāts tiek pārveidots par dzelzs sulfīdu.
Kliglera barotnes krāsas izmaiņu raksturs (23. att.) skaidrojams ar nevienlīdzīgo slāpekļa vielu sadalīšanās intensitāti mikroorganismu ietekmē un sārmainu produktu veidošanos aerobā (uz slīpas virsmas) un anaerobās (att. kolonna) nosacījumi.
Aerobos apstākļos uz slīpas virsmas notiek intensīvāka sārmu veidošanās nekā vidējā kolonnā. Tāpēc, sadaloties vidē nelielā daudzumā esošajai glikozei, skābe, kas veidojas uz slīpās virsmas, tiek ātri neitralizēta. Tajā pašā laikā laktozes sadalīšanās laikā, kas barotnē atrodas augstā koncentrācijā, sārmaini produkti nespēj neitralizēt skābi.
Anaerobos apstākļos kolonnā sārmaini produkti veidojas nenozīmīgā daudzumā, tāpēc šeit tiek konstatēta glikozes fermentācija.
Rīsi. 23. Kliglera indikatora vide:
1 — iniciālis,
2 - ar izaugsmi E. coli
3- ar izaugsmi S. paratyphi B,
4 - ar izaugsmi S. typhi
E. coli sadala glikozi un laktozi ar gāzu veidošanos, nerada sērūdeņradi. Tie izraisa kolonnas un slīpās daļas dzeltēšanu ar nesēju pārrāvumiem.
S. paratyphi sadala glikozi ar gāzu veidošanos, laktozes negatīvs. Tie izraisa kolonnas dzeltēšanu ar pārtraukumiem, slīpā daļa nemaina krāsu un paliek aveņu krāsa. Kurā S. paratyphi B ražot sērūdeņradi (injekcijas laikā parādās melna krāsa), S. paratyphi A sērūdeņradis netiek ražots.
S. typhi sadala glikozi bez gāzes veidošanās, laktozes negatīvs, rada sērūdeņradi. Tie izraisa kolonnas dzeltēšanu bez pārtraukumiem, slīpā daļa nemaina krāsu un paliek aveņaina, injekcijas laikā parādās melna krāsa.
Shigella spp. glikozes pozitīvs, laktozes negatīvs, nerada sērūdeņradi. Tie izraisa kolonnas dzeltēšanu (ar vai bez pārtraukumiem atkarībā no serovāra), slīpā daļa nemaina krāsu un paliek sārtināta.
B. Tīrkultūras galīgā identifikācija(izolētā mikroorganisma sistemātiskās pozīcijas noteikšana līdz sugas vai varianta līmenim) un izolētās kultūras jutīguma spektra noteikšana pret antibiotikām.
Lai identificētu tīrkultūru šajā posmā, tiek pētītas bioķīmiskās, ģenētiskās, seroloģiskās un bioloģiskās īpašības (8. tabula).
Parastā laboratorijas praksē identifikācijas laikā nav nepieciešams pētīt visas īpašības. Tiek izmantoti informatīvi, pieejami, vienkārši testi, kas ir pietiekami, lai noteiktu izolētā mikroorganisma sugu (variantu) piederību.
