Typy bakteriologického výskumu. Smernice. Metódy bakteriologického štúdia oportúnnych mikroorganizmov v klinickej mikrobiológii
SCHVÁLENÉ MZ RSFSR dňa 19.12.1991
Smernice zostavil A.N. Kalyuk.
Bakteriologické štúdie oportúnnych patogénov
Komplexná laboratórna štúdia mikroflóry zahŕňa bakterioskopické a bakteriologické štúdie materiálu, vykonávané v dynamike pri prijatí do ústavnej liečby, počas liečby, ako aj podľa indikácií u pacientov liečených ambulantne. Diagnostický materiál je vhodné naočkovať na husté živné pôdy, čo vylučuje potlačenie rastu jedného mikroorganizmu iným a umožňuje kvantitatívny odhad počtu narastených kolónií. Intenzitu rastu mikroorganizmov možno vyjadriť krížikmi a zodpovedá obsahu určitého počtu mikrobiálnych buniek v 1 ml diagnostického materiálu:
++++ Bohatý rast splývajúcich kolónií (10 m/cl)
+++ masívny rast izolovaných kolónií (10 m/bunka)
++ mierny rast mnohých spočítateľných kolónií (najmenej 50) (10-10 m/kl)
+ slabý rast jednotlivých kolónií (30-50) (10 m/bunka).
Pri dávkovanom výseve sa zisťuje absolútny obsah mikroorganizmov v 1 ml alebo 1 g testovaného materiálu. Etiologicky významný obsah baktérií v 1 ml (1 g) materiálu je 10 a viac. Kvantitatívna prevaha určitého typu mikroorganizmu je jedným z ukazovateľov jeho účasti na pyozápalovom procese. Konečná interpretácia výsledkov bakteriologického vyšetrenia sa robí po preštudovaní anamnestických údajov, klinických príznakov a výsledkov antibiotickej terapie. Pri odosielaní materiálu na siatie je potrebné dodržiavať určité pravidlá. Materiál je potrebné vyšetriť pred začiatkom antibiotickej terapie alebo po takom období po podaní antibakteriálnych liečiv, ktoré je nevyhnutné na ich elimináciu z tela pacienta (2-3 dni pri testoch v spúte, 4-7 dní pri moči). Použitie antibiotík znižuje frekvenciu izolácie mikroorganizmov 3-4 krát. Plodiny diagnostického materiálu sa vykonávajú v dynamike (3-5 krát), čo objasňuje etiológiu ochorenia, umožňuje sledovať trvanie pretrvávania patogénu a kontrolovať účinnosť terapie. Interval medzi zberom a výsevom materiálu by nemal presiahnuť 1-2 hodiny.
Štúdium mikroflóry zvršku dýchacieho traktu(hltan, nos, ústa). Materiál na štúdiu je: hlien, hnisavý výtok, kôry, film, kúsky infiltrátov počas biopsie. Materiál pre mikrobiologický výskum z ústna dutina odoberá sa nalačno sterilným vatovým tampónom zo sliznice na výstupe z kanálikov slinných žliaz, povrchu jazyka, z vredov (škrabanie lyžičkou), z najviac postihnutých miest. Ak existuje film, odstráni sa pomocou pinzety. Materiál z nosovej dutiny sa odoberá suchým sterilným vatovým tampónom. Materiál sa naočkuje na Petriho misky s krvou, žĺtkovo-soľnými agarmi, Saburovým médiom. Pri výseve tampónom sa materiál vtiera do média z celého povrchu tampónu na malej ploche 1-2 cm a potom sa ťahá po celom povrchu. Súčasne s výsevom sa pripravia a zafarbia nátery podľa Grama.
Štúdium mikroflóry dolných dýchacích ciest. Hlavným materiálom pre štúdiu je spútum, ktorý sa zhromažďuje v deň štúdie, ráno, po čistení zubov a opláchnutí úst čerstvo prevarenou vodou. o výdatné vylučovanie spúta, prvé porcie treba vykašľať do pľuvanca a ďalšie sa zbierajú do sterilných misiek a doručujú do laboratória. Na štúdium mikroflóry spúta sa používa výsev neriedeného spúta (kvalitatívnou metódou), ako aj metóda riedenia, ktorá sa nazýva kvantitatívna. Pri kvalitatívnej metóde výsevu sa používajú hnisavé hrudky spúta, premyté fyziologickým roztokom z mikroflóry ústnej dutiny. Pri kvantitatívnych metódach sa homogenizuje 1 ml spúta. Potom sa urobia riedenia, aby sa znížil počet orálnych mikroorganizmov v ňom. Pri oboch metódach sa náter pripravuje súčasne s kultúrou, ktorá sa farbí Gramom. Predmetom výskumu je hnisavý a mukopurulentný spút, v ktorom sú leukocyty a bunky alveolárneho epitelu, bunky rozptýlené v mucíne, ktorých prítomnosť je charakteristická pre vylučovanie dolných dýchacích ciest. Dávajte pozor na mikroflóru prevládajúcu v nátere natívneho spúta, najmä kapsulárne diplokoky (pneumokoky), malé gramnegatívne tyčinky (Pfeifferova tyčinka) atď.
metóda kvality. V laboratóriu sa spútum naleje do Petriho misky, vyberú sa 2-3 hnisavé hrudky, ktoré sa raz premyjú vo fyziologickom roztoku a potom sa naočkujú na krvné a žĺtkovo-soľné agary, Endo a Saburo media. Výsev sa vykonáva sterilnou sklenenou stierkou, pričom sa materiál rovnomerne rozotrie po povrchu živného média. Disky s antibiotikami (streptomycín, penicilín, tetracyklín, erytromycín a levomycetín) sa umiestnia na platňu s krvným agarom ihneď po naočkovaní, čo umožňuje získať expresnú informáciu o liekovej citlivosti mikroflóry prevládajúcej pri naočkovaní. Na druhý deň sa berie do úvahy počet vyrastených kolónií (za etiologicky významný sa považuje rast nad 50 kolónií), homogenita populácie a citlivosť na liečivá pri ich raste v monokultúre.
kvantitatívna metóda. Zo spúta dodaného do laboratória sa odoberie 1 ml, pridá sa 9 ml mäsovo-peptónového bujónu a homogenizuje sa v nádobe s guľôčkami počas 20 minút. Z výslednej emulzie sa pripravia desaťnásobné sériové riedenia. Výsev sa vykonáva v opačnom poradí z menšieho riedenia. Naočkujte 0,1 ml zriedeného spúta 10 a 10 na misku s krvným agarom. Výsev na žĺtkovo-soľný agar, Endo a Sabouraud médium sa robí z počiatočného riedenia 1:10. Plodiny sa inkubujú jeden deň pri 37 °C. Na druhý deň sa poháre prezerajú a berie sa do úvahy počet každého z typov mikroorganizmov v miliónoch. Bakteriálny obsah 10 m/cl a viac v 1 ml spúta sa považuje za diagnosticky významný.
Výsev prieduškových výplachov, výplachová tekutina. Z testovaného materiálu sa odoberú hrudky hlienu, ktoré sa bez predchádzajúceho premytia vo fyziologickom roztoku naočkujú na tuhé živné pôdy (pozri kultiváciu v spúte) a do skúmavky s cukrovým bujónom. Pri absencii hrudiek hlienu sa materiál zozbieraný v Pasteurovej pipete naočkuje. Inkubácia počas dňa pri 37°C.
Štúdium mikroflóry očí. Vzorky na výskum odoberá lekár sterilným vatovým tampónom alebo sklenenou tyčinkou. Materiál sa odoberie z postihnutých oblastí a vysieva sa v 0,5% cukrovom bujóne. Pri absencii rastu sa po 48 hodinách objaví negatívna odpoveď.
Vyšetrenie tampónov z ucha. Materiál sa odoberie sterilným vatovým tampónom zo zvukovodu a naočkuje sa na krvný a žĺtkovo-soľný agar, Sabouraudovo médium, pričom sa materiál rozotrie na plochu média a potom sa rozotrie po celej šálke.
Štúdia moču. Štúdia podlieha priemernej časti ranného moču získanej počas normálneho močenia alebo odobratej katétrom. Indikátor bakteriúrie, ktorý má klinický význam, sa uvažuje o prítomnosti 100 000 a viac mikróbov v 1 ml moču.
Prvý deň výskumu. Jedna štandardná (3 mm) bakteriologická slučka moču (dôkladne premiešaná) sa vysieva do sektorov A, I, II a III do Petriho misky s 5 % krvi alebo jednoduchého agaru. Súčasne sa v oblasti média sektora A siatie, rovnomerné trenie materiálu po celom povrchu, potom bez naberania nového materiálu, rovnaká slučka sa robí ťahmi na živnom médiu v sektor I (3-4 údery), z I. do II., z II sektora - v III.
stôl 1
Počet bakteriálnych kolónií v rôznych sektoroch Petriho misky v závislosti od stupňa bakteriúrie (podľa V.S. Rabinovského a V.V. Rodomana)
|
Počet baktérií v 1 ml moču |
Počet kolónií v rôznych sektoroch Petriho misky |
|||
|
Menej ako 1 tis |
žiadny rast |
žiadny rast |
||
|
veľmi veľký |
||||
|
z jednotky až do 25 |
||||
Druhý deň výskumu. Stupeň bakteriúrie sa určuje podľa tabuľky 1 v závislosti od sektora, v ktorom sa nachádza rast kolónií mikroorganizmu. V prítomnosti menej ako 100 tisíc mikróbov v 1 ml moču sa rast kolónií pozoruje iba v sektore A Petriho misky. Vzhľad rastu kolónií v sektore I naznačuje viac vysoký stupeň bakteriúria. Počítanie kolónií v sektore s najmenším rastom nie je ťažké. Metóda sektorových plodín vo väčšine prípadov umožňuje izolovať pôvodcu choroby v čistej kultúre už na druhý deň štúdie.
Štúdium mikroflóry rán, bodiek, exsudátov, resekovaných tkanív. Exsudáty a bodky sa naočkujú Pasteurovou pipetou do skúmaviek s krvou a jednoduchým mäsovo-peptónovým agarom, cukrovým vývarom. Na Petriho misky s 5 % krvi a 10 % agarov so žĺtkom a soľou sa vysije tampón s diagnostickým materiálom. Materiál sa rozotrie pozdĺž okraja média a potom sa rozotrie po miske pomocou rovnakého tampónu alebo bakteriologickej slučky.
Štúdium mikroflóry ženských pohlavných orgánov. Sekréty sa odoberú sterilným vatovým tampónom a naočkujú sa na Petriho misky s 5 % krvným agarom, žĺtkovo-soľným agarom a do skúmavky s cukrovým bujónom, ako aj na Endo médium.
Štúdium žlče. Žlč sa odoberá počas sondovania alebo počas operácie do sterilných skúmaviek a dodáva sa do laboratória najneskôr do 2 hodín od okamihu odberu. 0,1 ml žlče sa nanesie na platňu s krvným agarom a médium Endo. Plodiny a zvyšný zdrojový materiál sa umiestnia do termostatu na 37 °C. Po 24 hodinách sa vezmú do úvahy výsledky primárnej inokulácie s počítaním počtu kolónií každého druhu na hustom živnom médiu.
Štúdia krvi. Krv sa vysieva pri lôžku pacienta po starostlivom ošetrení pokožky (alkohol, éter). Z kubitálnej žily sa odoberie 10 ml krvi, ktorá sa naleje do dvoch baniek: do prvej so 150-200 ml cukrového bujónu a do druhej s tioglykolovým médiom (každá po 5 ml). Plodiny sa uchovávajú v termostate 10 dní. Na 2., 3., 5. a 10. deň sa uskutoční kontrolný výsev na Petriho misky s 5 % krvným agarom. Výsev 5 ml krvi sa môže uskutočniť do fľaštičky so živným médiom v dvoch fázach: tuhá a tekutá (skosenie 5 % krvného agaru s 1 % glukózy a 50 ml 0,5 % cukrového bujónu). Táto technika eliminuje potrebu viacnásobného výsevu, eliminuje možnosť kontaminácie úrody mikroflórou prostredia a umožňuje zohľadniť počet kolónií, ktoré vyrástli (tj. posúdiť intenzitu bakteriémie) . Výsev sa umiestni na 10 dní do termostatu pri 37 °C. Každý deň sa obsah fľaštičiek pretrepe a naklonením fľaštičky sa zvlhčí povrch skosenia hustého živného média. Keď kolónie rastú na šikmom krvnom agare, pripravia sa z nich nátery a ďalej sa identifikujú podľa pravidiel všeobecne uznávaných v bakteriológii. Pri absencii rastu mikroorganizmov na 10. deň je daná konečná odpoveď - krvná kultúra je sterilná.
Výskum črevnej dysbiózy. Ľubovoľné množstvo výkalov sa odoberie na vopred pripravené a zvážené (subpargamenový alebo voskový papier) sterilné papiere veľkosti 3x2 a odváži sa na torznej váhe. Papier spolu s materiálom vložíme do sterilnej skúmavky. Hmotnosť vzorky výkalov mínus hmotnosť papiera sa vynásobí 9. Súčet získaný po vynásobení sa rovná množstvu fyziologického roztoku, ktorý sa musí pridať do skúmavky. Riedenie 1:10 (I).
Napríklad: hmotnosť kusu papiera je 20 mg
hmotnosť fekálií s kusom papiera 420 mg
420-20 = 400 mg; 400 mg9 = 3600 (3,5 ml).
Po emulgácii sklenenou tyčinkou alebo sterilnou pipetou sa suspenzie nechajú stáť pri teplote miestnosti 10 až 15 minút a 0,1 ml sa prenesie do ďalšej skúmavky s 9,9 ml fyziologického roztoku (riedenie 10). Potom sa výkaly zriedia na titer 10. Z hlavného riedenia (10) sa uskutoční inokulácia na tuhé živné médiá, aby sa izolovali patogénne mikróby z čeľade čriev (Ploskirev, Levinovo médium). Súčasne sa robí masívna (0,5-1,0) inokulácia na tekuté obohacovacie médiá (Muller, seleničitan, horčík). Zo skúmavky, v ktorej sú výkaly zriedené na 10, sa pridá 0,1 ml na povrch média Sabouraud a JSA. Z riedenia 10 sa naočkujú platne s 0,5 % krvným agarom a médiom Endo, každá po 0,1 ml. Na získanie rastu izolovaných kolónií sa používajú sklenené guľôčky alebo špachtle. Sklenené okrúhle guľôčky 12-14 kusov (vopred sterilizované) sa spúšťajú do pohára so semenom. Miernym kývaním pohára s guľôčkami po dobu 1 minúty sa materiál rovnomerne rozloží po živnom médiu. Výsev s guľôčkami začína od média, na ktoré bolo zasiate najväčšie riedenie (10), pričom guľôčky sa prenesú do menšieho riedenia. Na izoláciu anaeróbnych bifidobaktérií naočkujte z riedení 10, 10 a 10 do 2 skúmaviek (0,1 a 1 ml každá) s Blaurockovým médiom regenerovaným počas 1 hodiny. Po naočkovaní sa skúmavky medzi dlaňami energicky otáčajú, aby sa suspenzia rovnomerne rozdelila. Prostredie pre pestovanie aeróbov je umiestnené v termostate pri 37°C (Sabouraud - pri 20°) na 18-24 hodín. Rast anaeróbov na Blaurockovom médiu sa berie do úvahy po 48-72 hodinách.Na druhý deň po zasiatí sa počet Escherichia coli a iných mikróbov v 1g trusu určí podľa počtu kolónií, ktoré vyrástli na príslušnej živine médium, prepočítané na množstvo naočkovaného materiálu a stupeň jeho zriedenia. Ak teda na médiu Endo vyrástlo 30 kolónií negatívnych na laktózu, keď sa naočkovalo 0,1 ml výkalov z riedenia 10 (1: 100 000), výpočet by sa mal vynásobiť 30 x 10 a 100 000, t.j. v 1 g bude 30 000 000 laktóz-negatívnych enterobaktérií. Do úvahy sa berie počet laktózo-negatívnych a hemolytických kolónií Escherichia coli, prítomnosť stafylokokov, Proteusov a iných mikroorganizmov. Stanovujú sa enzymatické vlastnosti a liečivá citlivosť mikroorganizmov. Nátery sa pripravujú zo skúmaviek s Blaurockovým médiom. Pod mikroskopom majú bifidobaktérie vzhľad charakteristických grampozitívnych tyčiniek, na koncoch zhrubnutých alebo rozvetvených, usporiadaných do podoby rímskej číslice V, často vo forme zhlukov. Odpoveď bakteriológa uvádza percentuálny alebo absolútny počet každej skupiny mikroorganizmov.
Identifikácia mikroorganizmov. Metódy identifikácie mikroorganizmov sú založené na štúdiu morfologických, kultúrnych, biochemických, antigénnych a iných vlastností kultúr.
Morfologické vlastnosti sa študujú bakterioskopiou diagnostického materiálu a náterov z kolónií pestovaných na hustých a tekutých kultivačných médiách. Nátery na podložných sklíčkach sa fixujú na plameni horáka alebo v tekutých fixátoroch (96 °, alkohol, Nikiforovova zmes) zafarbených podľa Grama. Pri prezeraní náterov zo spúta sa hodnotí všetka dostupná mikroflóra: prítomnosť zhlukov grampozitívnych kokov (stafylokoky, mikrokoky), reťazcov grampozitívnych kokov (streptokoky), malých kopijovitých diplokokov obklopených zónou nezafarbeného puzdra (pneumokoky) , gramnegatívne koky (neisseria); Gram-negatívne tyčinky (črevné, Pseudomonas aeruginosa, Proteus); Gramnegatívne tyčinky so zaoblenými koncami obklopené kapsulou vo forme svetlého halo (Klebsiella), malé gramnegatívne tyčinky vo forme zhlukov (hemofilné baktérie) atď. Bakterioskopické vyšetrenie je indikatívne. Ďalší výskum zahŕňa očkovanie materiálu na živné pôdy, izoláciu čistých kultúr, ich identifikáciu a stanovenie citlivosti na liečivá. Kultúrne vlastnosti sa študujú pri sledovaní pestovaných kultúr na pevných a tekutých živných médiách. Na hustých médiách sa berie do úvahy veľkosť kolónií, farba, priehľadnosť, tvar, prítomnosť pigmentu, hemolýza okolo kolónie a jej charakter atď. Na tekutých médiách je zaznamenaná ich priehľadnosť, prítomnosť sedimentu (spodný rast) alebo filmu na povrchu média. Štúdium biochemických vlastností je založené na stanovení enzymatickej sacharolytickej aktivity, schopnosti využívať živiny v aeróbnych a anaeróbnych podmienkach kultivácie. Antigénne vlastnosti kultúr sa študujú interakciou baktérií a ich antigénov s príslušnými antisérami (aglutinačné reakcie, imunofluorescencia atď.). Po preštudovaní morfologických a kultúrnych vlastností sa vykonajú diferenciálne testy s čistými kultúrami mikroorganizmov.
Gram-pozitívne koky. Grampozitívne koky patria do čeľade Micrococcaceae, ktorá zahŕňa rody Micrococcus a Staphylococcus a čeľaď Streptococcaceae.
Čeľaď Micrococcaceae. Pre lekársku mikrobiológiu je potrebné odlíšiť stafylokoky od mikrokokov. Študujú morfologické vlastnosti, hemolýzu, schopnosť rásť na médiu so soľou, tvorbu pigmentu, fermentáciu glukózy na kyselinu v anaeróbnych podmienkach, fermentáciu glycerolu. Mikrokoky majú 2-3 krát väčšiu veľkosť buniek (0,5-3,5 µm), nefermentujú glukózu v anaeróbnych podmienkach a glycerol a majú žltý až ružový pigment. Diferenciácia rôznych typov stafylokokov sa vykonáva podľa súboru testov: plazmo-koagulačná schopnosť, aktivita lecitinázy, fermentácia manitolu v anaeróbnych podmienkach, tvorba pigmentu, citlivosť na novobiocín (test je pozitívny na St. aureus a St. epidermidis a negatívny pre St. saprophyticus). Na izoláciu stafylokoka sa testovaný materiál naočkuje na diferenciálne diagnostické médium: agar so žĺtkom a soľou. Pri farbení podľa Grama je stafylokok zafarbený grampozitívne a nachádza sa jednotlivo, v pároch alebo tvorí zhluky vo forme nepravidelných hromádok. Stafylokok je odolný voči zvýšeným koncentráciám chloridu sodného (7-10%), ktorý sa používa na jeho izoláciu od patologického materiálu. Pri pestovaní na mäsovo-peptónovom vývare spôsobuje jeho rovnomerný zákal a vytvára vločkovitú zrazeninu. Na hustých živných médiách rastie stafylokok vo forme okrúhlych lesklých kolónií s hladkými okrajmi (priemer 0,5-1,5 mm). Na druhý deň štúdie sa hodnotí kvantitatívny rast vyrastených kolónií, berie sa do úvahy aktivita lecitinázy a izoluje sa čistá kultúra mikróbov (transplantovaná do skúmaviek s mliekom alebo jednoduchým šikmým agarom). Na tretí deň - dali testy na diferenciáciu a citlivosť na lieky.
Na stanovenie koagulázovej aktivity sa použije lyofilizovaná králičia krvná plazma, zriedená sterilným fyziologickým roztokom v pomere 1:5 a naliata do sterilných skúmaviek s objemom 0,5 ml. 1 slučka dennej agarovej kultúry testovaného kmeňa sa naočkuje do skúmavky a umiestni sa do termostatu pri 37 °C. Výsledky sa zaznamenávajú po 30 minútach, 1 hodine, 2 hodinách a 24 hodinách. Všetky stupne koagulácie plazmy z malej zrazeniny, ktorá zostáva nehybná, keď je skúmavka prevrátená, sa považujú za pozitívne.
Aktivita lecitinázy sa stanovuje na agare so žĺtkom a soľou. Reakcia sa zaznamenáva po 24 až 48 hodinách makroskopicky prítomnosťou zakalenej zóny a dúhovej koruny okolo kolónií stafylokokov, čo naznačuje prítomnosť enzýmu lecitinázy v nich.
Pri štúdiu fermentácie manitolu sa očkovanie dennej agarovej kultúry testovaného kmeňa uskutočňuje rohom v stĺpci 1% agaru s manitolom a vazelínovým olejom. Počas fermentácie manitolu sa agarový stĺpec zmení na modrý. Pozitívna reakcia sa považuje za fermentáciu 2/3 agarového stĺpca.
Na stanovenie pigmentovej tvorby kultúr stafylokokov sa tieto naočkujú na 10% mliečny agar. Účtovníctvo za 18-20 hodín.
Stanovenie hemolytickej schopnosti kultúry stafylokoka sa uskutočňuje na 5% krvnom agare (darcovská krv bez pridania antiseptík) za prítomnosti osvietenia okolo pestovaných kolónií, ktoré sú zreteľne detegovateľné v prechádzajúcom svetle. Pozitívny hemolytický test na ľudskom krvnom agare je zvyčajne spôsobený hemotoxínmi, pričom hlavnú úlohu v patogenéze stafylokokových infekcií zohráva alfa-toxín, ktorý je možné zistiť na králičom krvnom agare.
Čeľaď Streptococcaceae. Streptokoky sú veľkou a pomerne heterogénnou skupinou mikroorganizmov. Najviac študovaní sú aeróbni zástupcovia: Streptococcus pyogenes, S. faecalis, S. pneumoniae. Mikrób má guľovitý tvar, grampozitívny, v náteroch z hustých živných médií sa nachádza vo forme krátkych reťazcov 2-3 kokov, na tekutých živných pôdach dáva dlhšie reťazce. Pri pestovaní streptokokov treba brať do úvahy ich zvýšenú potrebu živiny Oh. Preto sa na kultiváciu streptokoka používajú živné pôdy obsahujúce glukózu (1%), krv (5-10%), sérum (10-20%).
ČINNOSŤ č. 4
TÉMA: FYZIOLÓGIA MIKROORGANIZMOV. BAKTERIOLOGICKÁ (KULTÚRNA) METÓDA VÝSKUMU. BIOCHEMICKÉ VLASTNOSTI MIKROORGANIZMOV.
KONTROLNÝ ZOZNAM
Výživa baktérií. Živiny sú zdrojom uhlíka a dusíka. Klasifikácia baktérií podľa druhov výživy Autotrofy a chemoorganotrofy
Rastové faktory a ich zdroje. Zdroje minerálnych prvkov.
Spôsoby a mechanizmy prenosu živín cez membránu.
Energetické nároky baktérií. Spôsoby získavania energie v autotrofoch (fotosyntéza, chemosyntéza). Zdroje a spôsoby získavania energie v chemoorganotrofoch.
Aeróbne a anaeróbne typy biologickej oxidácie v baktériách. Aeróbne, anaeróbne, fakultatívne anaeróbne a mikroaerofilné baktérie. Spôsoby vytvárania anaeróbnych podmienok.
Úlohy, etapy, výhody a nevýhody bakteriologickej (kultúrnej) výskumnej metódy.
Rast a rozmnožovanie mikroorganizmov. Reprodukčné metódy. Binárne (jednoduché) štiepenie, mechanizmus. Reprodukcia bakteriálnych populácií.
Princípy a metódy kultivácie baktérií. Výživové potreby mikróbov.
Živné pôdy na kultiváciu baktérií. požiadavky na živiny. Klasifikácia živných médií.
Podmienky a techniky kultivácie baktérií. Technika sejby na živné pôdy. Zákonitosti a charakter rastu baktérií na hustých a tekutých živných pôdach.
Metódy izolácie čistých kultúr aeróbnych a anaeróbnych baktérií.
Vlastnosti používané na identifikáciu izolovaných kultúr.
NEZÁVISLÁ A LABORATORNÁ PRÁCA
Bakteriologická metóda(fázy):
1 1. etapa izolácia čistej kultúry aeróbnych baktérií: A) Mikroskopia patologického materiálu.
Gramovo farbenie náterov z patologického materiálu. Náčrt lieku.
B) Osvojenie si pod vedením pedagóga techniky výsevu patologického materiálu bakteriologickou slučkou a špachtľou na platňové živné pôdy.Naočkovanie patologického materiálu bakteriologickou slučkou na lamelárny mäsovo-peptónový agar (MPA) na získanie izolovaných kolónií.
Klasifikácia kultivačných médií(uveďte oblasti použitia)
1. Podľa konzistencie:kvapalina (mäsovo-peptónový bujón, žlč, cukrový bujón), hutné (2-3% agar) a polotekuté (0,15-0,7% agar) médiá.
2. Podľa pôvodu:prirodzené - z mlieka, mäsa. vajcia, zemiaky, ľudské krvné sérum, živočíšne a iné produkty; umelé - 1) prírodné vyvážené zmesi živín v koncentráciách a kombináciách potrebných pre rast a rozmnožovanie mikroorganizmov, univerzálny zdroj dusíka a uhlíka - peptóny - produkty neúplného rozkladu bielkovín pomocou pepsínu alebo rôznych hydrolyzátov (ryby, kazeín, kvasnice a pod.) . 2) syntetický cpresné chemické zloženie Soton pre mykobaktérie, 199 pre bunky.
3. V zložení: jednoduché kultúrne médiá (mäso-peptónový bujón-MPB, mäsovo-peptónový agar-MPA) a s nepravda (KA = MPA + 5-10 % zvieracej krvi)
4. Podľa dohody:
ALE) všeobecný účel - univerzálny, určený na kultiváciu akýchkoľvek mikroorganizmov (MPA, KA)
B ) Špeciálnepre pestovanie mikroorganizmov, ktoré nerastú na univerzálnych médiách, diferenciáciu druhov a selektívnu izoláciu určitých typov mikroorganizmov:
voliteľný (výberový) na izoláciu určitých druhov mikroorganizmov a potlačenie rastu príbuzných - (soľný agar na stafylokoky).
diferenciálna diagnostika (DDS)-prostredia, ktoré umožňujú rozlíšiť medzi typmi baktérií enzymatickou aktivitou; Oni S vlastniť: 1) univerzálne živné médium (MPA, KA); 2) diferenciačný faktor - chemický substrát (napríklad uhľohydrát), ku ktorému je odlišný vzťah diagnostickým znakom pre daný mikrób 3) Indikátor, ktorého zmena farby indikuje biochemickú reakciu. (prostredia Endo, Ploskirev, Giss a iné).
diferenciálne selektívne (DS) - prostredia, ktoré umožňujú prideliť baktérie určitého druhu podľa ich fyziologických vlastností a odlíšiť sa od iných druhov podľa enzymatickú aktivitu Obsahujú: 1) MPA 2) voliteľné chemický substrát, ktorý inhibuje rast iných druhov baktérií . 3) rozlišovací faktor - substrát ku ktorému je diagnostický znak pre tento mikrób;) 4.) Indikátor, ktorého zmena farby indikuje biochemickú reakciu. (stredy na stafylokoky, ICA na salmonely, Ploskirev na šigely a salmonely).
B) Obohacovanie média na rozmnožovanie a akumuláciu baktérií určitého typu v klinickom materiáli (krv v 20% žlčovom bujóne = salmonela, výtok z hrdla v 10% sére + 2% telurit = korynebaktérie.)
D) Doprava médium na odber a dodávku (konzerváciu) klinického materiálu = 48 hodín (Amiesovo médium - polotekutý agar + aktívne uhlie).)
Živné médiá(príklady):
Streda Endo Stredný typ diferenciálna diagnostika enterobaktérií Nutričná báza MPA diferenciačný faktor laktóza 1% Indikátor zásaditý fuchsín odfarbený siričitanom sodným. E.s oli rozkladajú laktózu na kyselinu - kolónie sú červené s kovovým leskom, patogénne bezfarebné;
Soľný agar Stredný typ selektívne na izoláciu stafylokokov Nutričná báza MPA voliteľný faktor chlorid sodný 10%
Streda Ploskirev Stredný typ diferenciálne selektívnepre enterobaktérie
Nutričná báza MPA voliteľný faktor Žlčové soli diferenciačný faktor laktóza
Indikátor neutrálna červená
Žĺtkovo-soľný agar Stredný typ diferenciálne selektívne pre S . aureus _
Nutričná báza MPA voliteľný faktor chlorid sodný 10%
diferenciačný faktor žĺtok
Indikátor nie
2 2. fáza bakteriologická výskumná metóda (izolácia čistej kultúry):
A) Štúdium izolovaných kolónií (escherichia, stafylokok) na lamelárnej MPA.
|
Študoval kultúrne vlastnosti |
1 typ kolónií |
2 typ kolónie |
|
tvar kolónie |
Pravidelný tvar, okrúhly |
Správna forma |
|
Dôslednosť |
homogénne |
homogénne |
|
Veľkosť kolónie |
stredná (veľkosť 2-4 mm) | |
|
Povaha okraja |
s hladkými okrajmi |
s hladkými okrajmi |
|
Povrchová povaha |
konvexné |
B) Príprava náterov z vybraných kolónií (Gramovo farbenie).
C) Prenos izolovaných kolónií do šikmej MPA na akumuláciu čistej kultúry.
3 Izolácia čistej kultúry anaeróbnych baktérií: naočkovanie pôdnej suspenzie na médium Kitta-Tarozzi na izoláciu patogénnych klostrídií
Kitt-Tarozziho médium pozostáva zo živného bujónu, 0,5 % glukózy a kúskov pečene alebo mletého mäsa na absorbovanie kyslíka z média. Pred výsevom sa médium zahrieva vo vriacom vodnom kúpeli počas 20-30 minút, aby sa z média odstránil vzduch. Po zasiatí sa živné médium ihneď naplní vrstvou parafín
Metódy na vytvorenie anaerobiózy:
1.fyzické- odčerpanie vzduchu, zavedenie špeciálnej zmesi plynov bez kyslíka (zvyčajne N 2 - 85 % CO 2 - 10 %, H 2 - 5%), predbežné prevarenie kultivačného média, očkovanie do hlbokého stĺpca agaru, plnenie média vazelínovým olejom na zníženie prístupu kyslíka, použitie hermeticky uzavretých fľaštičiek a skúmaviek, striekačiek a laboratórneho skla s inertným plynom, použitie tesne uzavretých exsikátorov s horiacou sviečkou
2. Chemické - používajú sa chemické lapače kyslíka.
3. Biologické - spoločné pestovanie prísnych aeróbov a anaeróbov (aeróby absorbujú kyslík a vytvárajú podmienky pre rozmnožovanie anaeróbov - Fortnerova metóda).
Streda Kitt - Tarozzi pozostáva z živného vývaru, 0,5% glukózy a kúskov pečene alebo mletého mäsa na absorbovanie kyslíka z prostredia. Pred výsevom sa médium zahrieva vo vriacom vodnom kúpeli počas 20-30 minút, aby sa z média odstránil vzduch. Po zasiatí sa živné médium ihneď naplní vrstvouparafín alebo vazelínový olej na izoláciu od prístupu kyslíka.
4. Zmiešané - použiť niekoľko rôznych prístupov.
Na vytváranie anaeróbnych podmienok sa používajú špeciálne zariadenia - anaerostaty. V súčasnosti najjednoduchšie a najefektívnejšie zariadenie na vytváranie anaeróbnych a mikroaerofilných podmienok je chemická metóda so špeciálnymi vreckami fungujúcimi na princípe pohlcovania vzdušného kyslíka v hermeticky uzavretých nádobách .
Wilsonovo-Blairovo médium (tuby, poháre):
Nutričná báza MPA Respiračný substrát glukózy
Redukujúci faktor siričitan sodný a chlorid železitý siričitan sodnýNa 2 SO 3 → Na 2 S
Pre prostredie Wilson-Blair je základ agar s prídavkom glukózy , Clostridia forme na tomto médiu kolónie čierna farba v dôsledku reštaurovania siričitan predtým sulfid - anión , ktorý je spojený s katiónov žľaza (II) poskytuje čiernu soľ. Typicky čierna na tomto vzdelávacom médiu kolónie , objaví sa v hĺbke agarového stĺpca .
Tioglykolové médium (médium na kontrolu sterility): (rúrky):
Nutričná báza BCH Respiračný substrát glukózy Redukujúci faktor tioglykolát sodný
Indikátor resazurín
Zeisslerov agar s glukózou v krvi: (poháre): Nutričná báza MPA, krv
Respiračný substrát glukózy Redukujúci faktor hemoglobínu
Bol zavedený pojem „anaeróby“.Louis Pasteurktorý objavil v roku 1861baktériemaslová fermentácia.
ALEPrednáška 3 Fyziológia mikroorganizmov. Metabolizmus baktérií .
Fyziológia mikroorganizmov zahŕňa :
druhy potravín;
typy dýchania;
kultivácia (podmienky, prostredie, charakter a rýchlosť rastu);
biochemická aktivita;
variabilita;
biologická izolácia účinných látok toxíny a iné faktory patogenity;
citlivosť na antibiotiká, bakteriofágy, bakteriocíny;
iné biologické vlastnosti.
Metabolizmus baktérií - súbor fyzikálnych a chemických procesov (chemických premien a reakcií) zameraných na reprodukciu štruktúr a zabezpečenie životne dôležitých funkcií mikrobiálnej bunky, ako sú:
rast a reprodukcia;
ukladanie rezervného potravinového materiálu;
transport živín do mikrobiálnej bunky;
uvoľňovanie metabolických produktov (toxíny, enzýmy, antibiotiká a iné biologicky aktívne látky);
pohyb;
tvorba spór;
adhézia na citlivé receptory hostiteľských buniek a penetrácia do nich;
rôzne adaptívne reakcie na zmeny vonkajšieho prostredia.
Anabolizmus- súbor biochemických reakcií, pri ktorých sa uskutočňuje syntéza bunkových zložiek.
Katabolizmus- súbor reakcií, ktoré bunke dodávajú energiu.
Schéma štúdie metabolizmu - fázy:
1. Počiatočný (periférny) metabolizmus - prenikanie látok zvonku do bunky a rozpad na medziprodukty.
2. Amfibolizmus (intermediárny metabolizmus) - tvorba medziproduktov metabolizmu spoločných pre katabolické a anabolické dráhy.
3. Záverečné, prísne špecializované štádiá konštruktívneho metabolizmu (vedú k výstavbe bunkových štruktúr) a energetického metabolizmu (tvorba ATP).
Mechanizmy prenikania živín do bunky:
Jednoduchá difúzia (pre skutočné riešenia). energeticky nezávislý proces.
Uľahčená difúzia ("para downstream") - v smere koncentračného gradientu za účasti nosných proteínov. energeticky závislý proces.
Aktívny transport je proti koncentračnému a elektrochemickému gradientu za účasti permeáz (amino-, hydroxy-kyselina, iónová atď.). Proces prebieha s výdajom energie ATP, závisí od náboja látok a ich premeny v procese prenosu.
Mikroorganizmy sa delia do dvoch skupín podľa ich schopnosti absorbovať zdroje uhlíka: autotrofy (lat. autá - seba, trofej - výživa) syntetizujú všetky zložky bunky obsahujúce uhlík z CO 2 ako jediného zdroja uhlíka a heterotrofov (lat. heteros - druhý, „kŕmenie na úkor iných“), používajú rôzne organické zlúčeniny obsahujúce uhlík.
V závislosti od zdrojov energie sa mikroorganizmy delia aj na fototrofy (fotosyntetické), schopné využívať slnečnú energiu, a chemotrofy (chemosyntetické), prijímajúce energiu prostredníctvom redoxných reakcií.
V závislosti od použitých donorov elektrónov sa baktérie delia na litotrofy (s použitím anorganických donorov elektrónov) a organotrofy (s použitím organických zlúčenín).
Prototrofy- mikroorganizmy schopné syntetizovať všetky organické zlúčeniny, ktoré potrebujú, z glukózy a amónnych solí.
Auxotrofy- mikroorganizmy neschopné syntetizovať akékoľvek organické zlúčeniny. Tieto zlúčeniny získavajú v hotovej forme z prostredia alebo ľudského tela.
Enzýmy(z gréc. fermentum-sourdough) - vysoko špecifické proteínové katalyzátory prítomné vo všetkých živých bunkách, bez ktorých nie je možný život a rozmnožovanie. Enzýmy rozpoznávajú svoje príslušné metabolity (substráty), interagujú s nimi a urýchľujú chemické reakcie. Enzýmy sú bielkoviny.
Enzýmové zloženie mikroorganizmu je určené genómom a je pomerne stabilnou vlastnosťou. Stanovenie enzýmov sa široko používa na biochemickú identifikáciu baktérií.
Endoenzýmy katalyzujú metabolizmus v bunke.
Exoenzýmy sú vylučované bunkou do okolia.
Konštitutívny enzýmy sa neustále syntetizujú v určitých koncentráciách.
indukovateľný enzýmy sú enzýmy, ktorých koncentrácia sa zvyšuje s príjmom zodpovedajúceho substrátu.
Enzýmy agresie: hyaluronidáza, fibrinolyzín, neuraminidáza, kolagenáza, lecitináza (licitovitelláza), koaguláza, ureáza, dekarboxylázy aminokyselín, deoxyribonukleáza.
pestovanie- získavanie kultúr mikroorganizmov v umelom živnom médiu.
Kultivačné ciele:
získanie čistých kultúr patogénnych mikroorganizmov a ich identifikácia;
akumulácia biomasy producentov BAS (vitamíny, hormóny, aminokyseliny, antibiotiká atď.);
získavanie diagnostických a profylaktických prípravkov (vakcíny, diagnostika);
uchovávanie referenčných múzejných kultúr;
v sanitárnej mikrobiológii na určovanie sanitárno-indikačných mikroorganizmov - indikátorov znečistenia životného prostredia.
kultúra- populácia mikroorganizmov pestovaná na živnom médiu.
čistá kultúra- populácia jedného druhu mikroorganizmov vypestovaná z izolovanej kolónie na živnej pôde.
Väčšina patogénnych mikróbov sa pestuje na živnom médiu pri 37 °C počas 1-2 dní.
Klasifikácia kultivačných médií
Podľa konzistencie: tekutý, polotekutý, hustý.
Pôvod: prírodné (mlieko, zemiaky), umelé, polosyntetické, syntetické
V zložení: jednoduché (MPA, MPB, zelenina, mlieko), komplexné (1% glukóza, 10-20% sérum, 20-30% ascitická tekutina, 5-10% defibrinovaná krv).
Podľa dohody:
univerzálne - médiá, na ktorých dobre rastú mnohé druhy baktérií. Tieto zahŕňajú mäsový peptónový vývar (MPB) a mäsový peptónový agar (MPA);
špeciálne - médiá špeciálne pripravené na získanie rastu baktérií, ktoré nerastú na univerzálnych médiách;
diferenciálna diagnostika - prostredia, ktoré umožňujú rozlíšiť jeden typ baktérií od iných enzymatickou aktivitou;
selektívne - médiá obsahujúce látky používané mikroorganizmami určitých druhov a zabraňujúce rastu iných mikroorganizmov. Selektívne médiá vám umožňujú vybrať určité typy baktérií zo študovaného materiálu;
diferenciálno-selektívne - prostredia, ktoré kombinujú vlastnosti diferenciálne diagnostického a selektívneho prostredia;
konzervačný prostriedok;
sústredenie.
Rozmnožovanie baktérií na tekutých a hustých živných médiách.
rast koordinovaná reprodukcia všetkých zložiek bakteriálnej bunky a zvýšenie jej biomasy. reprodukcie- rozmnožovanie a zvyšovanie počtu buniek, čo vedie k vytvoreniu bakteriálnej populácie.
Baktérie sa vyznačujú vysokou mierou reprodukcie. Rýchlosť rozmnožovania závisí od druhu, zloženia živnej pôdy, pH, teploty a prevzdušňovania.
Na hustých živných médiách tvoria baktérie zhluky buniek nazývané kolónie. Kolónie odlišné typy líšia sa veľkosťou, tvarom, konzistenciou, farbou, povahou hrán, povahou povrchu, priehľadnosťou.
Charakter rastu na tekutých živných pôdach: filmový (tvorba filmu na povrchu živného média), difúzny zákal, blízko dna (tvorba sedimentu).
Fázy vývoja bakteriálnej populácie
Počiatočná stacionárna fáza (~ 1-2 hodiny). Počet baktérií sa nezvyšuje, bunky nerastú.
Fáza oneskorenia alebo fáza oneskorenia rozmnožovania (~ 2 hodiny).
Log-fáza - logaritmická alebo exponenciálna fáza (~ 3-5h). Obyvateľstvo je rozdelené maximálna rýchlosť a dochádza k exponenciálnemu nárastu jednotlivcov.
Fáza negatívneho zrýchlenia (~ 2 hodiny). Súvisí s vyčerpaním limitujúceho metabolitu alebo akumuláciou toxických metabolických produktov.
Stacionárna fáza maxima. Počet vytvorených a odumierajúcich buniek je rovnaký.
Fáza zrýchlenej smrti (~ 3 hodiny).
Logaritmická fáza smrti (~5).
Fáza znižovania miery úmrtnosti – zostávajúce živé jedince prechádzajú do kľudového stavu.
Energetický metabolizmus baktérií
Aeróby- mikroorganizmy, ktoré využívajú aeróbny (oxidačný) typ biologickej oxidácie substrátov. Metabolizmus aeróbov prebieha len za prítomnosti vysokej koncentrácie voľného kyslíka v biotope, ktorý pôsobí ako konečný akceptor elektrónov odoberaných zo substrátu. Kultivácia aeróbov sa uskutočňuje na médiách s plným prístupom k atmosférickému kyslíku.
povinných anaeróbov- mikroorganizmy využívajúce anaeróbny typ biologickej oxidácie (fermentácie). Metabolizmus prebieha len v prostrediach s nízkym redoxným potenciálom bez prítomnosti kyslíka.
Zvýšenie koncentrácie kyslíka v prostredí vedie k smrti vegetatívnych foriem.
Množstvo energie extrahovanej počas fermentácie je malé, preto sú povinné anaeróby nútené fermentovať veľké množstvo substrátu.
Fakultatívne anaeróby- mikroorganizmy schopné získavať energiu zo substrátov aeróbnymi (oxidačnými) a anaeróbnymi (fermentatívnymi) cestami biologickej oxidácie. Metabolizmus sa môže uskutočňovať za podmienok plného prístupu kyslíka do prostredia, ako aj za podmienok anaerobiózy.
Metódy vytvárania anaerobiózy
Fyzické
siatie v stĺpci cukru MPA;
varenie (regenerácia) tekutých živných médií s následným potiahnutím olejom;
mechanické odstraňovanie kyslíka v anaerostatoch;
nahradenie kyslíka indiferentným plynom;
Rúry Veillon-Vignal.
Chemický
aparát Aristovského;
Omelyanského sviečka (alkalický roztok pyrogallolu);
použitie chemických akceptorov kyslíka: glukóza, kyselina pyrohroznová, sodná soľ kyseliny mravčej atď.
Biologické
Streda Kitta-Tarozzi
Fortnerova metóda
Anaeróby - organizmy, ktoré získavajú energiu bez prístupu kyslík podľa substrátu fosforylácia , konečné produkty neúplnej oxidácie substrátu môžu byť oxidované väčšou energiou vo formeATP v prítomnosti terminálneho akceptora protónov organizmami, ktoré .
Anaeróbne dýchanie- agregát biochemické reakcie, vyskytujúce sa v bunkách živých organizmov, keď sa používa ako konečný akceptor protónov, nie kyslík a iné látky (napr. dusičnany) a odkazuje na procesy energetický metabolizmus(katabolizmus,disimilácia), ktoré sa vyznačujú oxidáciasacharidy,lipidov A aminokyseliny na zlúčeniny s nízkou molekulovou hmotnosťou.
ALE 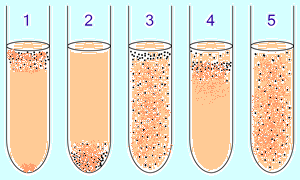 aeróbne a anaeróbne baktérie sú predbežne identifikované v tekutom živnom médiu pomocou gradientu koncentrácie O2:
aeróbne a anaeróbne baktérie sú predbežne identifikované v tekutom živnom médiu pomocou gradientu koncentrácie O2:
1. povinný aeróbny baktérie (náročné na kyslík) sa zhromažďujú hlavne v hornej časti skúmavky, aby absorbovali maximálne množstvo kyslíka. (Výnimka: mykobaktérie - rast filmu na povrchu v dôsledku voskovo-lipidovej membrány.)
2. obligátne anaeróbne baktérie sa zhromažďujú na dne, aby sa vyhli kyslíku (alebo nerástli). 3. Fakultatívne baktérie sa zhromažďujú hlavne v hornej časti ( Oxidačná fosforylácia je výhodnejšia ako glykolýza), možno ich však nájsť v celom médiu, pretože nezávisia od O2. 4 . mikroaerofily sa zhromažďujú v hornej časti trubice, ale ich optimum je nízka koncentrácia kyslíka. päť. Aerotolerantný anaeróby nereagujú na koncentrácie kyslíka a sú rovnomerne rozložené v skúmavke.
D 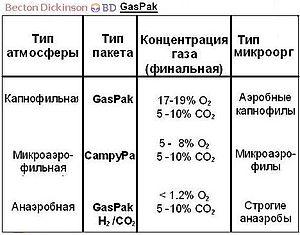 na meranie kapacita prostredia M. Clark navrhol použiť hodnotu pH20 – zápornú logaritmusčiastočný tlak plynný vodík. Rozsah charakterizuje všetky stupne nasýtenia vodný roztok vodík a kyslík. Aeróby rastú pri vyššom potenciáli, fakultatívne anaeróby a tie povinné pri najnižšom.)
na meranie kapacita prostredia M. Clark navrhol použiť hodnotu pH20 – zápornú logaritmusčiastočný tlak plynný vodík. Rozsah charakterizuje všetky stupne nasýtenia vodný roztok vodík a kyslík. Aeróby rastú pri vyššom potenciáli, fakultatívne anaeróby a tie povinné pri najnižšom.)
Klasifikácia anaeróbov, rozlišovať:
Fakultatívne anaeróby
Kapneistické anaeróby a mikroaerofily
Aerotolerantné anaeróby
Stredne prísne anaeróby
povinných anaeróbov
Ak je organizmus schopný prejsť z jednej metabolickej dráhy na druhú (napríklad z anaeróbneho dýchania na aeróbne a naopak), potom sa podmienečne označuje ako fakultatívne anaeróby .
Do roku 1991 sa v mikrobiológii rozlišovala trieda kapneistických anaeróbov, ktoré si vyžadovali zníženú koncentráciu kyslík a zvýšená koncentrácia oxidu uhličitého (Brucella bovinný typ - B. abortus)
Použitie bakteriologickej metódy umožňuje izolovať patogén v čistej kultúre z materiálu získaného od pacienta a identifikovať ho na základe štúdia komplexu vlastností. Väčšina baktérií je schopná kultivácie na rôznych umelých živných médiách (okrem chlamýdií a rickettsie), preto je bakteriologická metóda dôležitá pri diagnostike mnohých infekčných ochorení.
Ak sa získa pozitívny výsledok, bakteriologická metóda umožňuje určiť citlivosť izolovaného patogénu na antimikrobiálne lieky. Účinnosť tejto štúdie však závisí od mnohých parametrov, najmä od podmienky odberu a jeho dopravy do laboratória.
TO základné požiadavky požiadavky na výber a prepravu materiálu na bakteriologické vyšetrenie zahŕňajú:
- odber materiálu pred začiatkom etiotropnej liečby;
- dodržiavanie podmienok sterility pri odbere materiálu;
- technická správnosť zberu materiálu;
- dostatočné množstvo materiálu;
- zabezpečenie teplotného režimu skladovania a prepravy materiálu;
- skrátenie na minimálny časový interval medzi zberom materiálu a výsevom na husté živné pôdy.
Prevoz materiálu do laboratória by sa mal uskutočniť čo najskôr, maximálne však do 1-2 hodín po jeho odbere. Vzorky materiálu musia mať určitú teplotu; najmä normálne sterilné materiály (krv, cerebrospinálny mok) sa skladujú a dodávajú do laboratória pri 37 °C. Nesterilné materiály (moč, sekréty dýchacích ciest atď.) sa uchovávajú pri izbovej teplote najviac 1-2 hodiny alebo najviac jeden deň pri teplote 4 °C (v podmienkach chladničky v domácnosti). Ak nie je možné doručiť vzorky do laboratória v predpísanom časovom rámci, odporúča sa použiť transportné médiá určené na zachovanie životaschopnosti patogénov v podmienkach konzervácie.
Krv na výskum sa má odobrať pacientovi počas zvýšenia telesnej teploty, na začiatku nástupu horúčky. Odporúča sa vyšetrenie 3-4 vzoriek krvi odobratých s odstupom 4-6 hodín, čo je rozumné z hľadiska zníženia rizika „miznutia“ prechodnej bakteriémie a zvýšenia schopnosti potvrdiť etiologickú úlohu oportúnnej mikroflóry izolovanej z tzv. krv, ak sa táto mikroflóra nachádza vo viacerých vzorkách venóznej krvi. Vzorka krvi v množstve 10 ml u dospelého a 5 ml u detí sa naočkuje najmenej do dvoch fľaštičiek médiom pre aeróbne a anaeróbne mikroorganizmy v pomere 1:10. Žiaduce je aj jednorazové vyšetrenie arteriálnej krvi.
Vezmite cerebrospinálny mok(CSJ) vyrobí lekár lumbálnou punkciou v množstve 1-2 ml do suchej sterilnej skúmavky. Vzorka je okamžite doručená do laboratória, kde sa okamžite začne aj jej štúdium. Ak to nie je možné, materiál sa niekoľko hodín skladuje pri teplote 37 °C. Výrazne zvyšuje počet pozitívnych výsledkov bakteriologického vyšetrenia výsevom 1-2 kvapiek likvoru do skúmavky s polotekutou pôdou s glukózou a do Petriho misky s „krvným“ agarom. Na odoslanie materiálu sa používajú izotermické boxy, nahrievacie podložky, termosky alebo akékoľvek iné obaly, kde je udržiavaná teplota cca 37°C.
Výlučky na bakteriologické vyšetrenie sa odoberajú sterilnými drevenými špachtľami v množstve 3-5 g do sterilnej nádoby s tesne uzavretým viečkom. Štúdium odobratého materiálu by sa malo začať najneskôr o 2 hodiny neskôr. Ak nie je možné začať so štúdiom počas tejto doby, malo by sa odobrať malé množstvo materiálu a umiestniť ho do vhodného transportného média. Pri výbere výkalov by sa malo usilovať o odoslanie patologických nečistôt (hlien, hnis, častice epitelu atď.) na výskum, ak nejaké existujú, aby sa zabránilo vniknutiu krvných nečistôt s baktericídnymi vlastnosťami do materiálu.
Na odber materiálu je možné použiť rektálne tampóny (s vatovou špičkou). Tampón sa má navlhčiť sterilným izotonickým roztokom chloridu sodného alebo transportným médiom (nie olejovým gélom). Zavádza sa do rekta do hĺbky 5-6 cm a otáčaním tampónu ho opatrne vyberte, pričom kontrolujete výskyt farby výkalov na tampóne. Tampón sa umiestni do suchej skúmavky, ak sa štúdium materiálu začne do 2 hodín, inak - v transportnom médiu.
Moč(priemerná časť voľne uvoľneného moču) v množstve 3-5 ml sa odoberá do sterilnej misky po dôkladnej toalete vonkajších pohlavných orgánov. Je lepšie odobrať ranné časti moču.
Žlč zhromaždené pri duodenálnej sondáži v liečebná miestnosť oddelene v častiach A, B a C do troch sterilných skúmaviek pri dodržaní pravidiel asepsie.
Umyte vodu zo žalúdka zhromaždené v sterilných nádobách v množstve 20-50 ml. Treba mať na pamäti, že výplach žalúdka sa v týchto prípadoch vykonáva iba indiferentnými (nemajú bakteriostatický alebo baktericídny účinok na mikroorganizmy) roztokmi - najlepšie prevarenou vodou (bez pridania sódy, manganistanu draselného atď.).
Spútum. Ranný spút uvoľnený počas záchvatu kašľa sa zhromažďuje v sterilnej nádobe. Pred kašľom si pacient umyje zuby a vypláchne ústa prevarenou vodou, aby sa mechanicky odstránili zvyšky potravy, deskvamovaný epitel a mikroflóra ústnej dutiny.
Výplachová voda z priedušiek. Pri bronchoskopii sa vstrekne najviac 5 ml izotonického roztoku chloridu sodného a následne sa odsaje do sterilnej skúmavky.
Výtok z hltana, ústnej dutiny a nosa. Materiál z ústnej dutiny sa odoberá nalačno alebo 2 hodiny po jedle sterilným vatovým tampónom alebo lyžičkou zo sliznice a jej postihnutých oblastí pri vstupoch do vývodov slinných žliaz, povrchu jazyka, od vredov. Ak je tam film, ten sa odstráni sterilnou pinzetou. Materiál z nosovej dutiny sa odoberá suchým sterilným vatovým tampónom, ktorý sa zavedie hlboko do nosnej dutiny. Materiál z nosohltanu sa odoberie sterilným zadným faryngeálnym vatovým tampónom, ktorý sa opatrne zavedie cez nosný otvor do nosohltanu. Ak kašeľ začne súčasne, tampón sa neodstráni, kým kašeľ neskončí. Na vykonanie analýzy záškrtu sa súčasne skúmajú filmy a hlien z nosa a hltana, pričom sa materiál odoberá rôznymi tampónmi.
Testovaný materiál sa naočkuje na husté živné pôdy pomocou špeciálnych techník, aby sa dosiahol rast jednotlivých kolónií mikroorganizmov, ktoré sa potom preosejú, aby sa izolovala čistá kultúra patogénu.
Určité typy baktérií sa izolujú pomocou elektívnych (selektívnych) médií, ktoré spomaľujú rast cudzích mikroorganizmov alebo obsahujú látky, ktoré stimulujú rast určitých patogénnych mikróbov.
Mikroorganizmy izolované na živných pôdach identifikovať, t.j. určiť ich druhovú alebo typovú príslušnosť. V poslednej dobe sa na identifikáciu v zdravotníckej praxi využívajú mikrotestové systémy, čo sú panely so sadou diferenciálne diagnostických prostredí, čo urýchľuje štúdium. Mikrotestovacie systémy sa používajú aj na stanovenie citlivosti mikroorganizmov na antimikrobiálne liečivá riedením antibiotika v tekutom živnom médiu.
Pri hodnotení výsledkov bakteriologickej štúdie by mal lekár vziať do úvahy, že negatívny výsledok nemusí vždy znamenať neprítomnosť patogénu a môže súvisieť s použitím antimikrobiálnych liekov, vysokou mikrocídnou aktivitou krvi a technickými chybami. Detekcia patogénneho mikróbu v materiáli od pacienta mimo spojenia s klinický obraz možné v prípade rekonvalescencie, zdravého alebo prechodného bakteriálneho prenosu.
Izolácia podmienene patogénnych mikroorganizmov (Staphylococcus epidermidis, Escherichia coli) a dokonca aj saprofytov z krvi, podliehajúc všetkým pravidlám asepsie, by sa mala považovať za prejav bakteriémie, najmä ak sa tieto mikróby nachádzajú vo viac ako jednej vzorke materiálu alebo v rôznych substrátoch ( krv, moč), keďže pri znížení imunoreaktivity tela môžu byť tieto a iné „nepatogénne“ mikroorganizmy pôvodcami infekčných procesov vrátane sepsy.
Istou ťažkosťou je interpretácia výsledkov bakteriologického vyšetrenia nesterilných médií a to dôkaz etiologickej úlohy oportúnnych mikroorganizmov. V tomto prípade sa berú do úvahy také ukazovatele ako typ izolovaných kultúr, počet mikrobiálnych buniek daného typu v materiáli, ich opakovaná izolácia v priebehu ochorenia, prítomnosť monokultúry alebo asociácia mikroorganizmu. účet v komplexe.
Yushchuk N.D., Vengerov Yu.Ya.
Metóda bakteriologického výskumu. Izolácia patogénu z krvi (hemokultúra) je skorá metóda diagnostiky chorôb. Bakteriémia u pacientov s týfus-paratýfusom sa objavuje na konci Inkubačná doba a nevymizne počas celého febrilného obdobia ochorenia a pri relapsoch. Výsledky bakteriologického vyšetrenia do určitej miery závisia od načasovania odberu materiálu a množstva naočkovanej krvi. Čím skôr sa hemokultúry vykonávajú od začiatku ochorenia, tým väčšia je pravdepodobnosť odhalenia patogénu. V prvom týždni brušného týfusu sa pacientovi odoberie krv z cubitálnej žily v množstve 10 ml, neskôr a počas relapsov - 20 ml.
V prvý deň štúdia krv sa naočkuje v pomere 1:10 do jedného z tekutých médií. Špecifikovaný pomer sa musí prísne dodržiavať, pretože pri menšom zriedení krvi môžu mikróby zomrieť v dôsledku jej baktericídneho účinku. Na siatie používajú: 10% alebo 20% roztok žlčového bujónu, naliaty do 50-100 ml fliaš, mäsovo-peptónový bujón s prídavkom 1% glukózy, sterilnú destilovanú vodu - podľa metódy NN Klodnitského, v ktorej dochádza k lýze erytrocytov, produkty ich rozpadu zároveň slúžia ako dobré živné médium na rozmnožovanie baktérií. Môžete použiť aj sterilnú vodu z vodovodu. Najlepšie výsledky sa dosiahnu naočkovaním materiálu na žlčový vývar. Ak nie je možné vykonať hemokultúru na mieste, sérum spolu so zrazeninou alebo citrátovou krvou (10 ml krvi sa naleje do skúmavky s 2 ml 5% sterilného citrátu sodného) sa posiela do laboratória. Krvná zrazenina sa v laboratóriu rozdrví a naočkuje do jedného z uvedených médií. Fľaštičky sú umiestnené v termostate pri teplote 37 °C.
Druhý deň výskumu. Po 14-24 hodinách od začiatku štúdie sa materiál naočkuje do Petriho misky na Endovo médium alebo médium s eozínom a metylénovou modrou (Levinovo médium). Ploskirevovo médium sa neodporúča používať na siatie, pretože bacily týfusu a paratýfu v krvi sú povinné paratrofy podľa typu výživy a nemenia tento typ výživy okamžite na metatrofické (t. j. mŕtve organické substráty). Preto na tomto médiu obsahujúcom žlčové soli bacily brušného týfusu rastú veľmi zle alebo nerastú vôbec. Pri absencii rastu baktérií po prvom výseve sa ďalšie produkujú po 48, 72 hodinách a na 5. a 10. deň. Ak súčasne nebolo možné izolovať patogén, vydá sa negatívna odpoveď. V pochybných prípadoch sa odporúča pravidelne - 1 krát za 3-4 dni - pestovať plodiny až do 24. dňa od okamihu odberu materiálu. Na 7. deň je stále vydaná negatívna odpoveď.
Tretí deň výskumu. Identifikujú sa „podozrivé“ kolónie pestované na médiu Endo a Levin (kolónie patogénnych mikróbov na médiu Endo sú bezfarebné), pre ktoré sú 2-3 kolónie subkultivované na šikmom agare a Resselovom médiu.
Štvrtý deň výskumu. Výsledky inokulácie na Resselovom médiu sa zohľadnia a zaznamenajú, morfologické vlastnosti izolovaných kultúr sa študujú v Gramovo farbenom nátere. Mobilita sa zisťuje - prítomnosť alebo neprítomnosť bičíkov - v zavesenej alebo rozdrvenej kvapke odobratej zo 4-6-hodinovej bujónovej kultúry. Za týmto účelom sa agarová kultúra (jedna slučka) naočkuje do 1 ml mierne zahriateho bujónu. Vybrané kultúry (2-3 skúmavky) sa subkultivujú na Gissovom médiu s manitolom, sacharózou a šikmým agarom, ako aj v 2 skúmavkách s mäsovo-peptónovým bujónom, v ktorých sú prúžky filtračného papiera navlhčené špeciálnymi roztokmi na stanovenie vodíka. sulfid a indol sa umiestnia pod zátky (rozložený "pestrý rad").
Piaty deň výskumu. Zmeny sa registrujú v rozšírenom „pestrofarebnom riadku“. V prítomnosti tvorby plynu sa uskutoční aglutinačná reakcia so zmesou sér salmonely. o pozitívna reakcia vykonať aglutinačnú reakciu s O- a H-sérami a vydať konečnú odpoveď založenú na súhrne všetkých znakov.
Izolácia myelokultúry sa uskutočňuje naočkovaním získaného bodkovaného kostnej drene v 3-5 ml sterilnej hovädzej žlče alebo v 25-30 ml 10% žlčového bujónu, vloží sa do termostatu a na druhý deň sa preoseje na Endo resp. Wilson-Blair médiá. V budúcnosti sú fázy výskumu rovnaké.
Izolácia baktérií z výkalov. Od 8. do 10. dňa choroby, častejšie od tretieho týždňa, sa u pacientov s brušným týfusom vylučujú paratýfusové baktérie s výkalmi. Na výskum sa odoberú posledné časti tekutých výkalov, emulgujú sa v izotonickom roztoku chloridu sodného (v pomere 1:10) a nechajú sa 30 minút, kým sa neusadia veľké častice. Na siatie sa odoberie kvapka materiálu z povrchu kvapaliny.
V prvý deň štúdie sa materiál naočkuje na obohacovacie médium - žlčový bujón, horčíkové médium, Muller, Kaufman - a umiestni sa do termostatu. Druhý deň štúdie sa z obohacovacieho média naočkuje na platne s médiami Ploskirev, Endo alebo Levin a Wilson-Blair (bizmut-sulfitový agar). Nasledujúce štádiá štúdie sú rovnaké ako pri izolácii krvnej kultúry.
Izolácia baktérií skupiny týfus-paratýfus z moču sa najlepšie robí od druhého do tretieho týždňa choroby. Pred odberom materiálu sa má vonkajší otvor močovej trubice umyť sterilným izotonickým roztokom chloridu sodného; u žien je lepšie odoberať moč katétrom. Na výskum vezmite 20-30 ml moču. Po odstredení sa sediment naočkuje do 2 pohárov Ploskirevovým médiom alebo bizmutovo-sulfitovým agarom. Supernatant sa naočkuje na obohacovacie médium (10 % žlčový bujón) a umiestni sa do termostatu na 24 hodín, potom sa naočkuje do 2 pohárov jedného z voliteľných médií. Izolované kolónie sa identifikujú obvyklým spôsobom.
Vyšetrenie obsahu dvanástnika – žlč. Metóda sa častejšie využíva v štádiu rekonvalescencie. Žlč sa odoberá počas sondovania do sterilných skúmaviek. Obsah dvanástnika sa naočkuje do fľaštičiek s 50 ml bujónu a zvyšok materiálu sa spolu s inokuláciami vloží do termostatu pri 37 °C. Nasledujúci deň sa naočkuje do 2 pohárov hustým diferenciálnym médiom . Vybrané kolónie sa identifikujú opísanou metódou.
Vysoko citlivá a perspektívna pri včasnej diagnostike brušného týfusu a paratýfusu je metóda imunofluorescencie, pri ktorej sa vyšetruje krv od prvých dní ochorenia, výkaly od 10. dňa, obsah dvanástnika na 10. deň. normálna teplota telo. Baktérie týfus-paratýfus sú označené špecifickými fluorescenčnými sérami, ktoré sú následne stanovené fluorescenčnou mikroskopiou. Metóda umožňuje diagnostikovať ochorenie za 10-12 hodín od začiatku štúdie.
Sérologická diagnostika ochorení týfusu a paratýfu. Od druhého týždňa ochorenia sa v krvi pacientov objavujú špecifické protilátky, ktoré sa dajú určiť pomocou Vidalovej reakcie. Pri brušnom týfuse a paratýfuse sa hromadia O- a potom H-aglutiníny. V priebehu ochorenia sa niekedy zistia aj Vi-aglutiníny, ktoré však na rozdiel od nosičov nemajú žiadnu diagnostickú hodnotu. Stanovenie špecifických aglutinínov v krvi pacientov na pôvodcu brušného týfusu a paratýfusu (Vidalova reakcia) môže pomôcť pri stanovení diagnózy ako v akútnom období ochorenia, tak aj počas rekonvalescencie.
Pri salmonelóze je Vidalova reakcia pomocnou diagnostickou metódou. Malo by sa pamätať na to, že často existujú formy ochorenia s miernou imunologickou odpoveďou. Obzvlášť často sa u pacientov liečených antibiotikami zaznamenávajú nízke titre aglutinínov až do ich absencie.
Na Vidalovu reakciu sa odoberú 1-3 ml krvi z prsta alebo z lakťovej žily do sterilnej skúmavky. Aby sa urýchlila zrážanlivosť krvi, umiestni sa na 30 minút do termostatu. Zrazená krv sa krúži sklenenou pipetou a umiestni sa do chladničky, kým sa neobjaví číre, usadené sérum. Zrazenina sa používa na siatie (hemokultúru). Aglutinačná reakcia sa uskutočňuje pomocou diagnostiky H- a O-tyfus, A- a B-paratyfus. Sérum sa zriedi, začínajúc titrom 1:100 až 1:800, podľa nasledujúcej metódy. Do skúmavky sa naleje 9,9 ml sterilného izotonického roztoku chloridu sodného a 0,1 ml testovacieho séra - získa sa riedenie 1:100. V 4 skúmavkách (podľa počtu antigénov použitých pri Vidalovej reakcii) a v jednej, ktorá slúži ako kontrola séra, sa do 1 ml naleje 5 ml zriedeného séra. Zo zostávajúcich 5 ml séra (riedenie 1:100) sa naleje 1 ml a do 4 ml sa pridajú 4 ml izotonického roztoku chloridu sodného a získa sa riedenie 1:200. 4 ml z riedenia 1:200 sa tiež nalejú do 4 skúmaviek po 1 ml a do zvyšných 4 ml sa opäť pridajú 4 ml izotonického roztoku chloridu sodného, aby sa získalo riedenie 1:400. Nasledujúce riedenia (1:800, 1:1600) sa vyrobia opísaným spôsobom. Do 4 skúmaviek, ktoré sú kontrolnými antigénmi, nalejte 1 ml izotonického roztoku chloridu sodného. Do všetkých experimentálnych skúmaviek, okrem tých, ktoré slúžia ako kontrola séra, sa nakvapkajú 1-2 kvapky príslušného diagnostického činidla. Stojan so skúmavkami sa pretrepe a umiestni na 24 hodín do termostatu pri 37 ° C. H-aglutinácia (hrubozrnná) nastáva po 2 hodinách, O-aglutinácia (jemnozrnná) - oveľa neskôr. Intenzita reakcie sa zaznamená po 24 hodinách Diagnostický titer Vidalovej reakcie pri riedení najmenej 1:200 v prítomnosti klinických prejavov.
Treba mať na pamäti, že táto reakcia môže byť pozitívna aj pri iných ochoreniach – tuberkulóze, malárii, brucelóze, malígnych novotvaroch a niektorých stavoch (tehotenstvo). Vidalova reakcia môže byť pozitívna aj u zdravých jedincov (domáca reakcia), u očkovaných a ktorí v minulosti mali nejaké ochorenie (anamnestická reakcia). Na zvýšenie špecificity Vidalovej reakcie Fischer navrhol riedenie séra hypertonickým roztokom chloridu sodného (2,9 a 5,8 %). To vedie k oslabeniu alebo eliminácii skupinových reakcií. Hodnota aglutinačnej reakcie sa zvyšuje s opakovanými štúdiami, keď sa zvyšuje titer protilátok s dynamikou ochorenia. Pri paratýfuse A môže byť Vidalova reakcia negatívna alebo titer špecifických protilátok je nižší ako skupina.
V posledných rokoch sa na rozpoznanie črevnej skupiny ochorení široko používa reakcia pasívnej hemaglutinácie (RPHA) s parciálnymi antigénmi týfusových baktérií. RPHA sa robí s vysokou senzitivitou a špecifickosťou, je pozitívna od 5. dňa choroby. Minimálny diagnostický titer u pacientov s brušným týfusom, paratýfusom, salmonelózou s O-antigénom je 1:200. Reakcia sa uvedie do dynamiky, aby sa určil nárast titra protilátok.
Metódy laboratórnej diagnostiky bakterionosiča pri brušnom týfuse a paratýfuse. Bakteriologické vyšetrenie výkalov, moču a duodenálneho obsahu sa vykonáva podľa všeobecne uznávaných metód. Najlepšie výsledky sa dosiahnu pri použití seleničitanových médií.
Kvôli frekvencii izolácie baktérií často nie je možné zasiať patogén. U drvivej väčšiny prenášačov bacilov brušného týfusu sa nachádzajú mikróby obsahujúce Vi-antigén, a preto sa Vi-protilátky objavujú v krvi akútnych a chronických nosičov (v krvi pacientov sú menej časté). Diagnostický titer reakcie je 1:20 a viac. Paralelne s Vi-aglutinačnou reakciou (s ohriatym sérom) sa uskutočňuje Vidalova reakcia (s natívnym sérom) s H- a O-tyfoidnými diagnostikami. V sére nosičov baktérií týfusu sa H-protilátky v titri od 1:200 do 1:800 nachádzajú v 60-80% prípadov. Prítomnosť kombinácie H- a Vi-protilátok má mimoriadnu diagnostickú hodnotu pri identifikácii nosičov bacilov brušného týfusu.
Z doplnkových výskumných metód sa na identifikáciu nosičstva bacilov týfusu používa kožný alergický test s týfom, ako aj RPHA s Vi antigénom.
Dôležitou podmienkou úspechu boja proti týfus-paratýfusom je teda včasná a úplná identifikácia a neutralizácia zdroja infekcie. V súčasnosti sa brušný týfus vyskytuje sporadicky. Priebeh ochorenia je zároveň menej dlhý a nie je sprevádzaný všetkými znakmi typickými pre klasickú formu, čo sťažuje klinické rozpoznanie.
V súvislosti s vyššie uvedeným má veľký význam komplexné laboratórne vyšetrenie.
Bakteriologická výskumná metóda (BLMI)- metóda založená na izolácii čistých kultúr baktérií kultiváciou na živných pôdach a ich identifikácii k druhu na základe štúdia morfologických, kultúrnych, biochemických, genetických, sérologických, biologických, ekologických charakteristík mikroorganizmov.
Bakteriologická diagnostika infekcií sa vykonáva pomocou štandardných diagnostických schém schválených ministerstvom zdravotníctva.
Čistá kultúra - baktérie rovnakého druhu pestované na živnom médiu, ktorých vlastnosti sú v štádiu skúmania.
Kmeň- identifikovaná čistá kultúra mikroorganizmov rovnakého druhu izolovaná z konkrétneho zdroja v konkrétnom čase. Kmene toho istého druhu sa môžu nevýznamne líšiť v biochemických, genetických, sérologických, biologických a iných vlastnostiach, ako aj v mieste a čase izolácie.
Ciele BLMI:
1. Etiologická diagnóza: izolácia čistej kultúry mikroorganizmov a jej identifikácia.
2. Stanovenie ďalších vlastností, napríklad citlivosti mikroorganizmu na antibiotiká a bakteriofágy.
3. Stanovenie počtu mikroorganizmov (dôležité pri diagnostike infekcií spôsobených UPM).
4. Typizácia mikroorganizmov, teda stanovenie vnútrodruhových rozdielov na základe štúdie genetické A epidemiologické(fagovary a sérovary) značky. Používa sa na epidemiologické účely, pretože vám umožňuje zistiť zhodnosť mikroorganizmov izolovaných od rôznych pacientov a z rôznych objektov vonkajšieho prostredia, v rôznych nemocniciach, geografických oblastiach.
BLMI zahŕňa niekoľko fáz, odlišné pre aeróby, fakultatívne anaeróby a obligátne anaeróby.
I. Etapy BLMI v izolácii čistej kultúry aeróbov a fakultatívnych anaeróbov.
Etapa.
A. Zber, preprava, skladovanie, Predbežné spracovanie materiál. Niekedy sa pred výsevom uskutočňuje selektívne spracovanie materiálu, berúc do úvahy vlastnosti izolovaného mikroorganizmu. Napríklad pred vyšetrením spúta alebo iného materiálu na prítomnosť kyselinovzdorného Mycobacterium tuberculosis sa materiál ošetrí kyslými alebo zásaditými roztokmi.
B. Naočkovanie do obohacovacieho média(ak je to potrebné).Vykonáva sa, ak testovaný materiál obsahuje malé množstvo baktérií, napríklad pri izolácii krvnej kultúry. Za týmto účelom sa krv odobratá vo výške horúčky vo veľkom objeme (8–10 ml u dospelých, 4–5 ml u detí) naočkuje do média v pomere 1:10 (na prekonanie účinku krvi baktericídnym faktory); výsev sa inkubuje pri teplote 37 0 C 18-24 hodín.
B. Mikroskopia testovaného materiálu. Z testovaného materiálu sa pripraví náter, zafarbí sa Gramovou alebo inou metódou a podrobí sa mikroskopii. Posúďte prítomnú mikroflóru, jej množstvo. V priebehu ďalšieho výskumu by sa mali izolovať mikroorganizmy prítomné v primárnom nátere.
G. Výsev na živnom médiu s cieľom získať izolované kolónie. Materiál sa naočkuje slučkou alebo špachtľou mechanickou separáciou na platni s diferenciálnym diagnostickým alebo selektívnym médiom, aby sa získali izolované kolónie. Po vysiatí sa miska obráti hore dnom (aby sa zabránilo rozmazaniu kolónií kvapôčkami kondenzovanej kvapaliny), podpíše sa a umiestni sa do termostatu pri teplote 37 °C na 18-24 hodín.
Treba pamätať na to, že pri výseve a preosievaní mikrobiálnych kultúr treba upozorniť pracovníka na dodržiavanie pravidiel asepsie, aby sa zabránilo kontaminácii živných médií a zabránilo sa infekcii iných osôb a samoinfekcii!
V prípade infekcií spôsobených oportúnnymi mikroorganizmami, kde záleží na počte mikroorganizmov prítomných v patologickom materiáli, sa vykoná kvantitatívna inokulácia materiálu, pre ktorú sa pripraví séria 100-násobných riedení materiálu (zvyčajne 3 riedenia). v sterilnom izotonickom roztoku chloridu sodného v skúmavkách. Potom sa 50 μl každého riedenia vysije na živné médium v Petriho miskách.
Etapa.
A. Štúdium morfotypov kolónií na médiách, ich mikroskopia. Prezerajú si riad a všímajú si optimálne živné médium, rýchlosť rastu a povahu rastu mikroorganizmov. Vyberte si štúdium izolované kolónie umiestnené pozdĺž zdvihu, bližšie k stredu. Ak rastie niekoľko typov kolónií, každý sa skúma samostatne. Posúďte znaky kolónií (tabuľka 7). V prípade potreby sa platne s plodinami prezerajú cez lupu alebo pomocou mikroskopu s malým zväčšením a zúženou clonou. Študujú farbiace vlastnosti rôznych morfotypov kolónií; na tento účel sa pripravuje časť skúmanej kolónie mazať, zafarbené Gramom alebo inými metódami, mikroskopicky a určiť morfológiu čistoty kultúry. orientačná RA na skle s polyvalentnými sérami.
B. Akumulácia čistej kultúry. Na akumuláciu čistej kultúry sa izolované kolónie všetkých morfotypov subkultivujú do samostatných skúmaviek so šikmým agarom alebo iným živným médiom a inkubujú sa v termostate pri +37 0 C (táto teplota je optimálna pre väčšinu mikroorganizmov, ale môže sa líšiť, napríklad pre Campylobacterium spp.- +42 0 C, Candida spp. a Yersinia pestis- +25 °C).
Kliglerovo médium sa zvyčajne používa ako akumulačné médium pre enterobaktérie.
Zloženie Kliglerovho média: MPA, 0,1% glukóza, 1% laktóza, sírovodíkové činidlo (síran železitý + tiosíran sodný + siričitan sodný), indikátor fenolová červeň. Počiatočná farba média je malinovočervená, médium je v skúmavkách „šikmé“: má stĺpik (2/3) a skosený povrch (1/3).
Výsev do Kliglerovho média sa vykonáva zdvihom po povrchu a vstrekom do stĺpca.
Etapa.
A. Účtovanie rastu na akumulačnom médiu, hodnotenie čistoty kultúry v Gramovom nátere. rastové vzorce izolovaná čistá kultúra. Vizuálne čistá kultúra sa vyznačuje rovnomerným rastom. o mikroskopické vyšetrenie sfarbený náter pripravený z takejto kultúry sa v nej nachádzajú v rôznych zorných poliach morfologicky a tinctoriálne homogénne bunky. V prípade výrazného pleomorfizmu vlastného niektorým typom baktérií sa však bunky s odlišnou morfológiou môžu vyskytovať súčasne v náteroch z čistej kultúry.
Ak bolo ako akumulačné médium použité Kliglerovo indikátorové médium, tak sa hodnotia jeho farebné zmeny v stĺpci a skosenej časti, podľa ktorých sa stanovujú biochemické vlastnosti: fermentácia glukózy, laktózy a tvorba sírovodíka. Pri rozklade laktózy šikmá časť média zožltne, pri rozklade glukózy stĺpec zožltne. Pri tvorbe CO 2 pri rozklade cukrov vznikajú bublinky plynu alebo prasklina v kolóne. V prípade výroby sírovodíka sa pozdĺž vstrekovania zaznamená sčernanie v dôsledku premeny síranu železnatého na sulfid železnatý.
Charakter zmeny farby Kliglerovho média (obr. 23) sa vysvetľuje nerovnakou intenzitou rozkladu dusíkatých látok mikroorganizmami a tvorbou alkalických produktov za aeróbneho (na šikmej ploche) a anaeróbneho (v a. stĺpec) podmienky.
V aeróbnych podmienkach dochádza k intenzívnejšej tvorbe alkálií na šikmej ploche ako v strednom stĺpci. Preto pri rozklade glukózy prítomnej v médiu v malom množstve sa kyselina vznikajúca na skosenej ploche rýchlo neutralizuje. Zároveň pri rozklade laktózy, ktorá je v médiu prítomná vo vysokej koncentrácii, alkalické produkty nie sú schopné kyselinu neutralizovať.
Za anaeróbnych podmienok v kolóne vznikajú alkalické produkty v nevýznamnom množstve, preto sa tu zisťuje fermentácia glukózy.
Ryža. 23. Stredný indikátor Kligler:
1 - počiatočné,
2 - s rastom E. coli
3- s rastom S. paratyphi B,
4 - s rastom S. typhi
E. coli rozkladajú glukózu a laktózu za tvorby plynov, nevytvárajú sírovodík. Spôsobujú žltnutie stĺpika a skosenej časti s prerušením média.
S. paratyphi rozkladajú glukózu s tvorbou plynu, laktóza-neg. Spôsobujú žltnutie stĺpika s prestávkami, skosená časť nemení farbu a zostáva malinová. V čom S. paratyphi B produkovať sírovodík (pri injekcii sa objaví čierna farba), S. paratyphi A nevzniká sírovodík.
S. typhi rozkladajú glukózu bez tvorby plynov, laktóza-negatívna, produkujú sírovodík. Spôsobujú, že stĺpec bez prestávok zožltne, skosená časť nemení farbu a zostáva malinová, pri nástreku sa objaví čierna farba.
Shigella spp. glukózo-pozitívne, laktózovo-negatívne, neprodukujú sírovodík. Spôsobujú žltnutie stĺpca (s prestávkami alebo bez nich v závislosti od sérovaru), skosená časť nemení farbu a zostáva karmínová.
B. Konečná identifikácia čistej kultúry(určenie systematickej polohy izolovaného mikroorganizmu na úrovni druhu alebo variantu) a stanovenie spektra citlivosti izolovanej kultúry na antibiotiká.
Na identifikáciu čistej kultúry v tomto štádiu sa študujú biochemické, genetické, sérologické a biologické charakteristiky (tabuľka 8).
V bežnej laboratórnej praxi nie je potrebné pri identifikácii študovať všetky vlastnosti. Používajú sa informatívne, dostupné, jednoduché testy, dostatočné na určenie druhovej (variantnej) príslušnosti izolovaného mikroorganizmu.
